·信达生物玛仕度肽头对头司美格鲁肽达到主要终点

来源:信达生物官微
公开资料显示,DREAMS-3(NCT06184568)是一项多中心、随机、开放标签Ⅲ期临床研究,入组经单纯饮食运动干预伴/不伴二甲双胍单药治疗血糖、体重控制不佳的中国早期2型糖尿病(病程<10年)合并肥胖受试者349例[平均年龄42.4岁,平均病程1.8年,平均基线糖化血红蛋白(HbA1c)8.02%,平均基线体重90.47kg,平均基线BMI=32.98 kg/m2],以1:1比例随机接受玛仕度肽6mg或司美格鲁肽1mg治疗32周(常规治疗期)。完成常规治疗期后,原接受玛仕度肽治疗的受试者根据体重达标情况,分配至玛仕度肽不同剂量继续治疗24周(研究扩展期)。主要终点为第32周时HbA1c<7.0%且体重较基线下降≥10%的受试者比例。
研究结果证明,在中国2型糖尿病合并肥胖受试者中,第32周时,玛仕度肽组HbA1c<7.0%且体重较基线下降≥10%的受试者比例为48.0%,优效于司美格鲁肽组(21.0%,P值<0.0001)。此外,第32周时,玛仕度肽组和司美格鲁肽组HbA1c较基线变化均值分别为−2.03%和−1.84%,体重较基线平均百分比降幅分别为10.29%和6.00%(P值均<0.05)。研究期间玛仕度肽整体安全性特征与既往临床研究一致,未发现新增安全性信号。胃肠道不良反应是最常见的不良事件,多为轻度或中度。该临床研究数据计划在未来学术大会或期刊上公布。
·诺华CDK2抑制剂在国内申报临床
10月27日,CDE官网显示,诺华的CDK2抑制剂ECI830临床试验申请获受理。这是国内第4款申报临床的CDK2抑制剂。
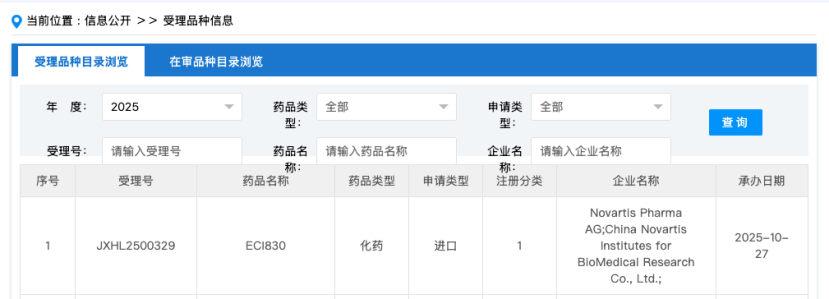
来源:CDE官网
据悉,ECI830是一款CDK2抑制剂,目前正在美国、日本、韩国等国家和地区开展HR阳性/HER2阴性乳腺癌及其他实体瘤的Ⅰ/Ⅱ期临床。
Insight数据库统计,目前全球有48款CDK2抑制剂在研(仅统计处于积极状态的新药),其中进入临床阶段的有9款。目前推进最快的是 Incyte 开发的 INCB0123667,正在开展卵巢上皮癌的Ⅲ期临床。国内进入临床的有3款,分别是Tagtociclib(辉瑞)、ARTS-021(安锐生物)和BG-68501(百济神州/昂胜医药)。
·康方生物依沃西单抗新适应症拟纳入突破性疗法
10月24日,CDE官网显示,康方生物AK112注射液(依沃西单抗)又一项申请拟纳入突破性治疗,适应症为依沃西单抗联合化疗一线治疗局部晚期不可切除或转移性三阴性乳腺癌。
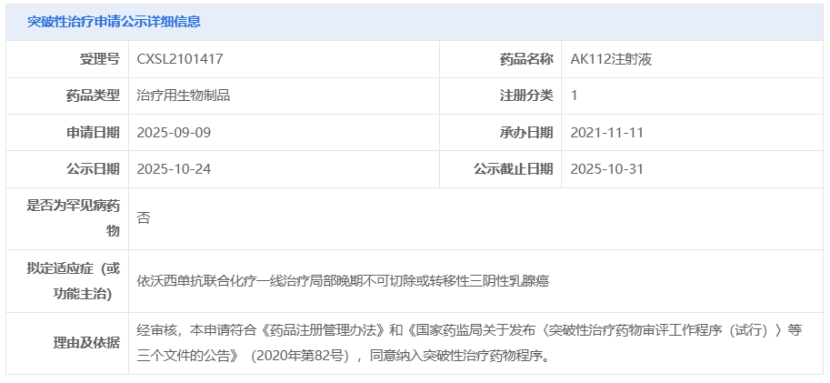
来源:CDE官网
公开资料显示,依沃西单抗是康方生物自主研发的、全球首创PD-1/VEGF双特异性肿瘤免疫治疗药物。此前,该药已有三项申请被CDE纳入突破性治疗品种,适应症分别为:一线治疗PD-L1表达阳性(TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC);联合化疗治疗经EGFR-TKI治疗失败的EGFR突变的局部晚期或转移性非鳞 NSCLC;联合多西他赛治疗既往PD-1/L1抑制剂和含铂化疗治疗失败的局部晚期或转移性NSCLC。
目前,康方正在国内开展一项随机、对照、多中心Ⅲ期临床研究(CTR20250033),以评估依沃西联合注射用紫杉醇 (白蛋白结合型) 对比安慰剂联合注射用紫杉醇 (白蛋白结合型) 一线治疗PD-L1阴性的局部晚期不可切除或转移性三阴性乳腺癌的效果和安全性。
依沃西单抗已在国内获批两项适应症,分别为:联合培美曲塞和卡铂用于经EGFR-TKI治疗进展的EGFR基因突变阳性的局部晚期或转移性非鳞状NSCLC患者的治疗;单药用于PD-L1阳性的EGFR基因突变阴性和ALK阴性的局部晚期或转移性NSCLC的一线治疗。
今年7月,依沃西单抗的第三个适应症上市申请获得国家药监局受理,联合化疗一线治疗晚期鳞状NSCLC。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx