据 Insight 数据库统计,10 月份(10.1-10.27),有 9 款国产新药首次进入 III 期临床阶段,开始向上市申请发起冲刺。
从药物类型来看,包括 4 款化药和 5 款生物药。本文从中选择部分项目跟大家分享。
10 月首次进入 III 期的国产新药
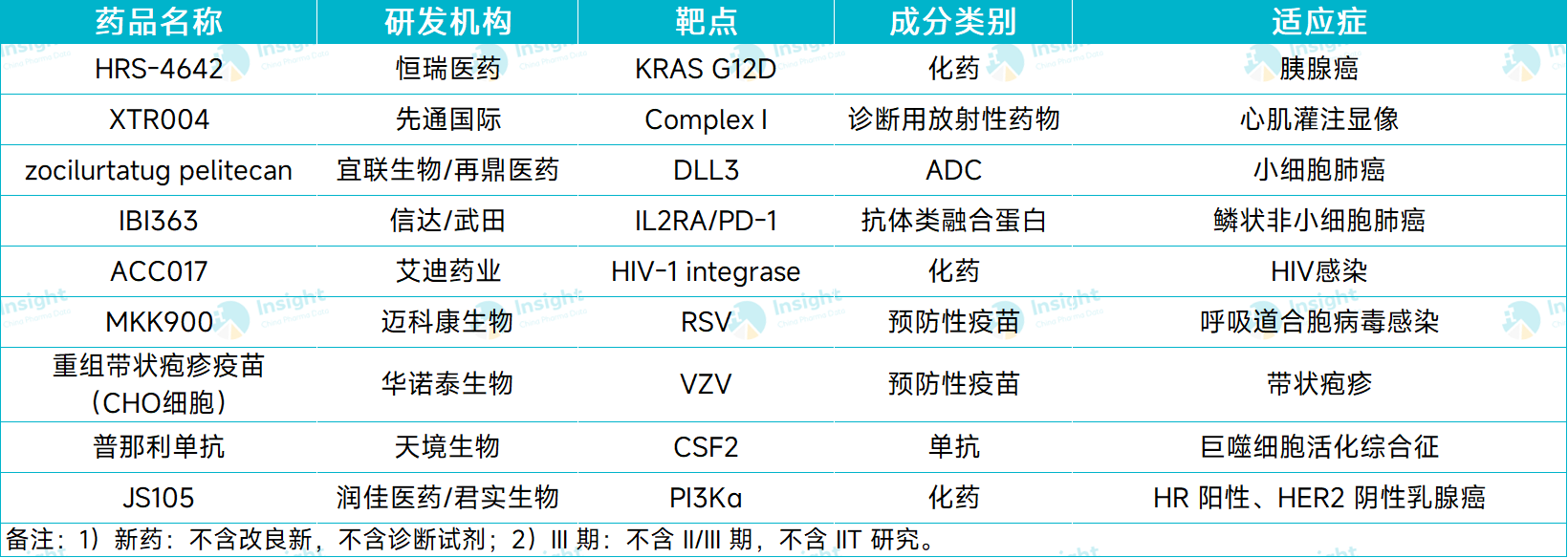
图片来源:Insight 数据库整理(数据统计时间:10.1-10.27)

信达PD-1/IL-2α-bias 双抗融合蛋白
10 月 11 日,信达生物在中国和美国启动了一项随机、开放、多中心、III 期研究,旨在评估 IBI363 对比多西他赛在经含铂化疗及抗 PD-1/PD-L1 免疫治疗失败的局部晚期或转移性鳞状非小细胞肺癌患者中的有效性和安全性。
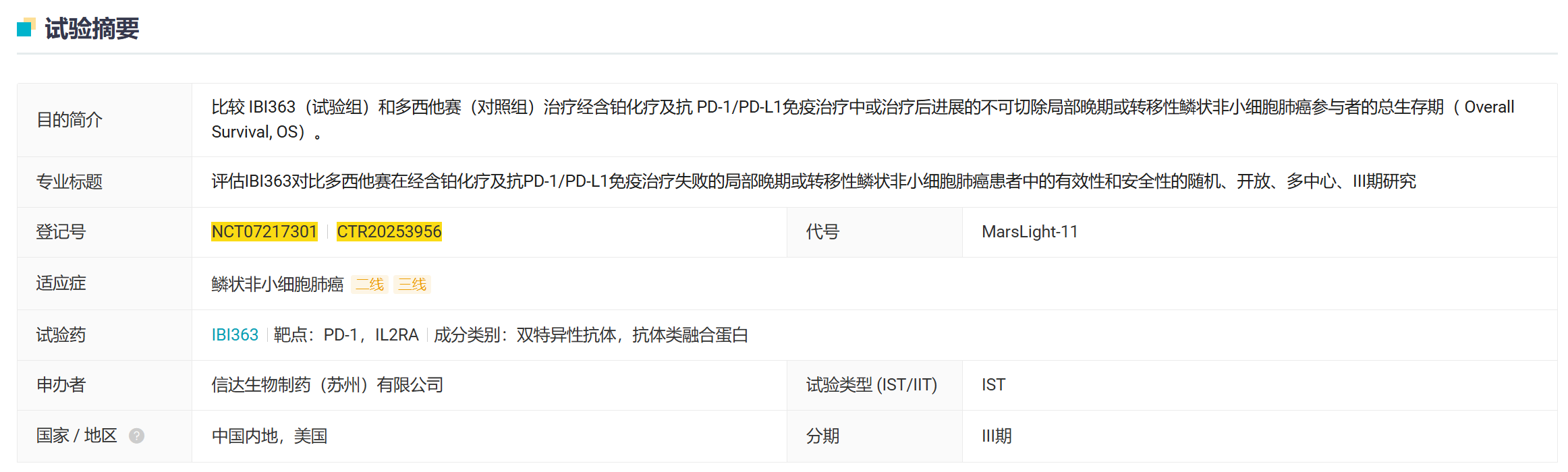
截图来源:Insight 数据库
IBI363 是信达自主研发的全球首创 PD-1/IL-2α-bias 双特异性抗体融合蛋白,可同时阻断 PD-1/PD-L1 通路并激活 IL-2 通路。
在 2025 年 ASCO 年会上,IBI363 在首批探索的非小细胞肺癌、结直肠癌、黑色素瘤 3 项免疫耐药及冷肿瘤中,均以口头报告形式报道了令人鼓舞的 I/II 期临床数据,从肿瘤响应到长期生存获益,全面地展现了 IBI363 在各适应症的突破性临床研究结果和双免疫激活的创新机理。(推荐阅读:全球首创!信达生物公布 PD-1/IL-2α-bias 双抗融合蛋白三项最新临床数据)
值得一提的是,就在本月,信达和武田已经就 IBI363 以及其他两款药物达成了合作协议,双方将在全球范围内共同开发新一代 IO 基石疗法 IBI363,并在美国共同商业化,武田制药将在共同治理和协同一致的开发计划下主导相关工作;同时,信达生物授予武田制药 IBI363 在除大中华区及美国以外地区的商业化权益。
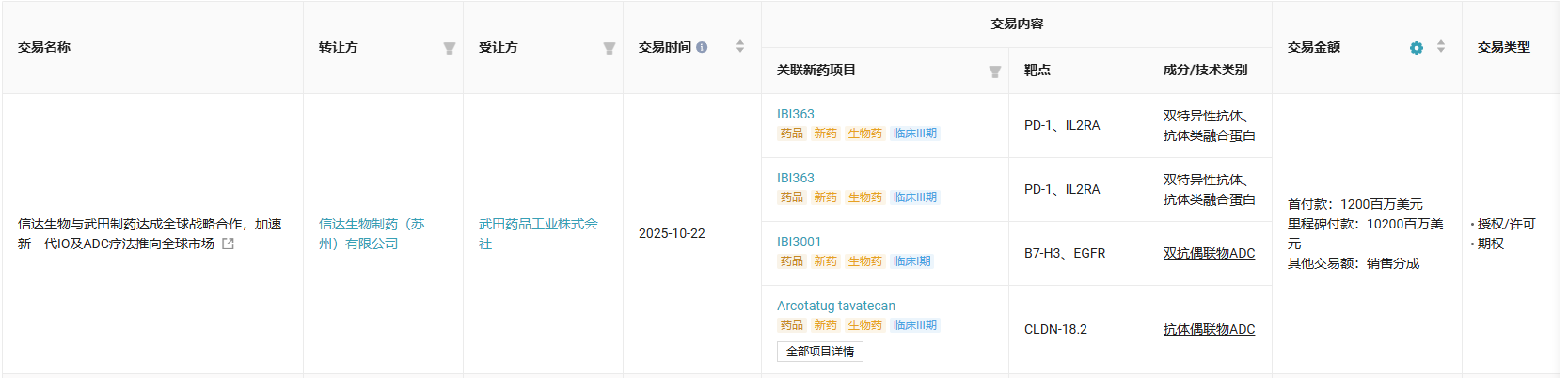
截图来源:Insight 数据库

恒瑞KRAS G12D 抑制剂
10 月 24 日,恒瑞在国内启动一项随机、对照、双盲、多中心 III 期临床研究,旨在评价 HRS-4642 联合吉西他滨+白蛋白结合型紫杉醇(AG)方案对比安慰剂联合 AG 方案一线治疗携带 KRAS G12D 基因突变的晚期或转移性胰腺癌的有效性和安全性。
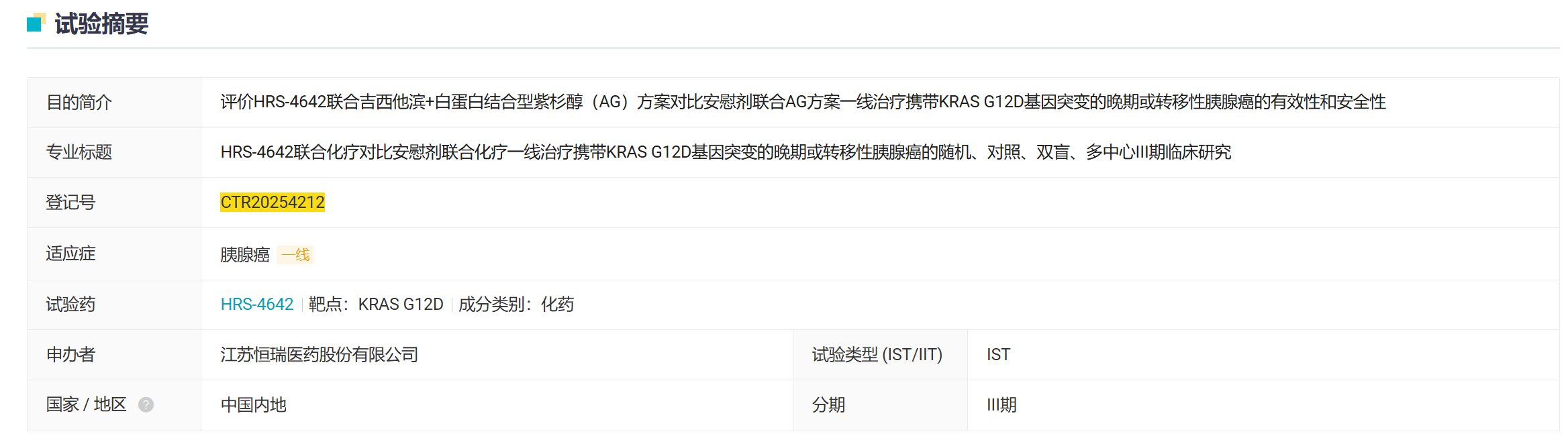
截图来源:Insight 数据库
HRS-4642 是一种高选择性、长效、非共价 KRAS G12D 抑制剂。在 2025 年 ESMO 大会上,恒瑞以口头报告的形式披露了一项该药的 Ib/II 期临床研究结果。截至 2025 年 4 月 10 日,该研究共纳入 31 例胰腺癌患者。30 例初治患者中,确认的 ORR 为 60%,DCR 为 93.3%。安全性方面,未发生导致治疗终止的治疗相关的不良事件。研究结果表明,HRS-4642 联合 AG 方案在晚期 KRAS G12D 突变型胰腺导管腺癌(PDAC)中显示出令人鼓舞的抗肿瘤活性和可控的安全性。长期疗效和安全性数据的随访正在进行中。
截图来源:Insight 数据库
Insight 数据库显示,目前全球范围内共有超 30 款 KRAS G12D 抑制剂在研,其中 HRS-4642 是首个进入 III 期临床的 KRAS G12D 抑制剂。
截图来源:Insight 数据库

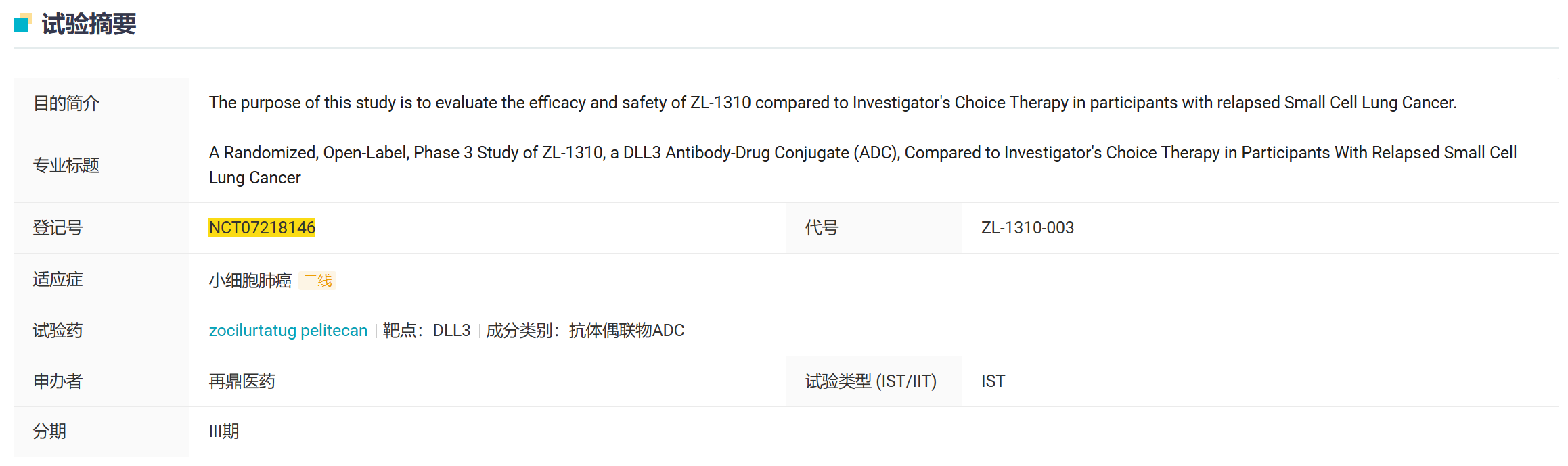
10 月 17 日,再鼎启动了一项随机、开放标签、全球 III 期临床试验,对比了 ZL-1310 与研究者选择的疗法在复发性小细胞肺癌患者中的疗效和安全性。该试验计划在包括北美、亚洲和欧洲的全球范围内入组约 665 例患者。
截图来源:Insight 数据库
ZL-1310(Zocilurtatug pelitecan)是一种靶向 DLL3 的 ADC,也是全球进度最快的 DLL3 ADC。此前,其已在复发/难治性 ES-SCLC 患者中显示出同类最佳潜力。日前,美国 FDA 已授予其快速通道资格,用于治疗 ES-SCLC 。
10 月 24 日,再鼎医药公布 ZL-1310 最新 I 期临床数据。数据截止日为 2025 年 9 月 15 日。其中 102 例患者至少完成过一次基于实体瘤疗效评价标准 1.1 版(RECIST v1.1)的基线后肿瘤评估。数据显示:
在重度经治的患者中观察到强劲缓解,1.6 mg/kg 剂量组用于二线治疗的客观缓解率(ORR)达 68%;
对基线伴有脑转移的患者(n=32)展现出显著活性,既往未接受过脑部放疗的患者 ORR 达 80%;
所有剂量组及所有治疗线次的中位缓解持续时间达 6.1 个月;1.2 mg/kg 与 1.6 mg/kg 剂量组仍在入组,到数据截止日时近半数缓解者仍在持续治疗;
潜在同类最佳安全性特征,≥3 级治疗相关不良事件发生率低,1.6 mg/kg 剂量组未出现治疗终止事件。
截图来源:Insight 数据库

10 月 3 日,润佳医药在国内启动一项随机、开放、多中心 III 期临床研究,旨在 PIK3CA 突变、HR 阳性、HER2 阴性复发或转移性乳腺癌患者中评价 JS105 联合达尔西利和氟维司群对比达尔西利和氟维司群的疗效和安全性。

截图来源:Insight 数据库
JS105是润佳医药和君实共同开发的一种选择性 PI3Kα 抑制剂,能高选择性地结合 PI3Kα,从而通过阻断 PI3K-AKT-mTOR 信号通路,抑制肿瘤细胞的生长,同时可能抵抗通路活化相关的治疗耐药。在 2025 年 ESMO 大会上,君实首次公布了两项 I 期临床研究结果,展示了 JS105 单药及联合治疗在中国晚期肿瘤患者中的初步疗效、安全性和药代动力学特征。截至 2025 年 5 月 30 日,单药治疗研究共入组 69 例患者,其中 44 例患者存在 PIK3CA 突变;41 例患者既往接受过≥2 线治疗。截至 2025 年 8 月 19 日,联合治疗研究入组 33 例患者,其中 30 例患者存在 PIK3CA 突变;22 例患者除辅助内分泌治疗外,既往未接受过任何系统性抗肿瘤治疗。此外,两项研究中,均有近 50% 的患者合并糖尿病或糖尿病前期。单药治疗研究中,无患者出现剂量限制性毒性(DLT),JS105 的 RP2D 确定为 250 mg。在 32 例伴 PIK3CA 突变的患者中,ORR 为 28.1%,DCR 为 87.5%。中位 PFS 为 4.4 个月,中位缓解持续时间(DoR)为 4.2 个月。其中,14 例 PIK3CA 突变乳腺癌患者中,DCR 达 92.9%,中位 PFS 为 6.3 个月。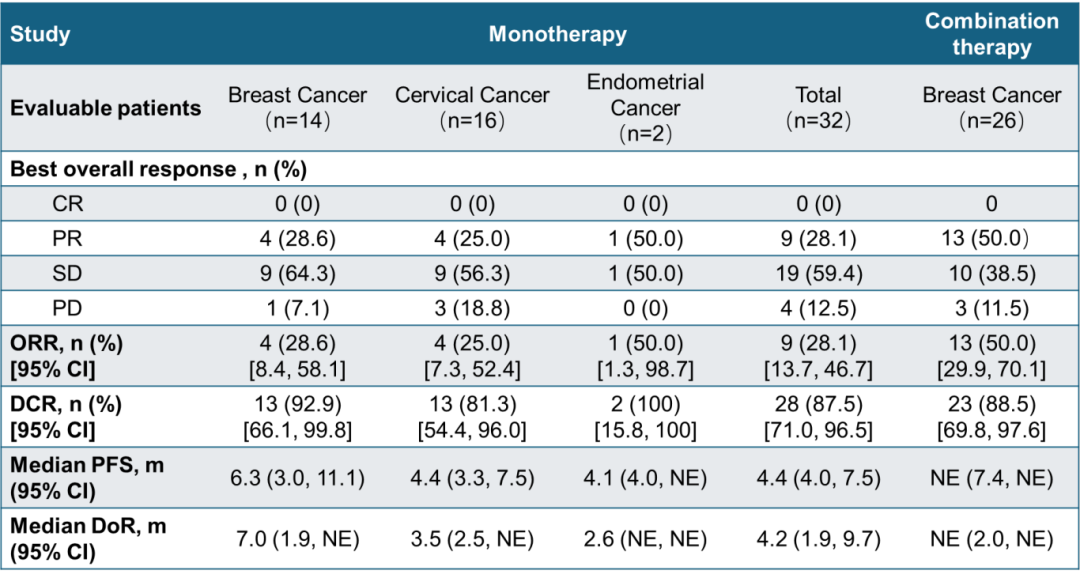
截图来源:企业官微
联合治疗研究中,最终确定的 RP2D 方案为 JS105 250 mg 联合达尔西利 125 mg 和氟维司群 500 mg。在 26 例伴 PIK3CA 突变的 HR+、HER2-乳腺癌患者中,ORR 达 50.0%,DCR 达 88.5%,中位 PFS 尚未达到。总体安全性可管理,大多数治疗相关不良事件(TRAEs)可通过干预得到管理。常见的 TRAEs(根据靶点和药物特征选定的治疗相关安全性事件)如下表所示。单药治疗和联合治疗研究中,分别有 5.8% 和 3.0% 的患者因 TRAEs 导致 JS105 治疗终止。 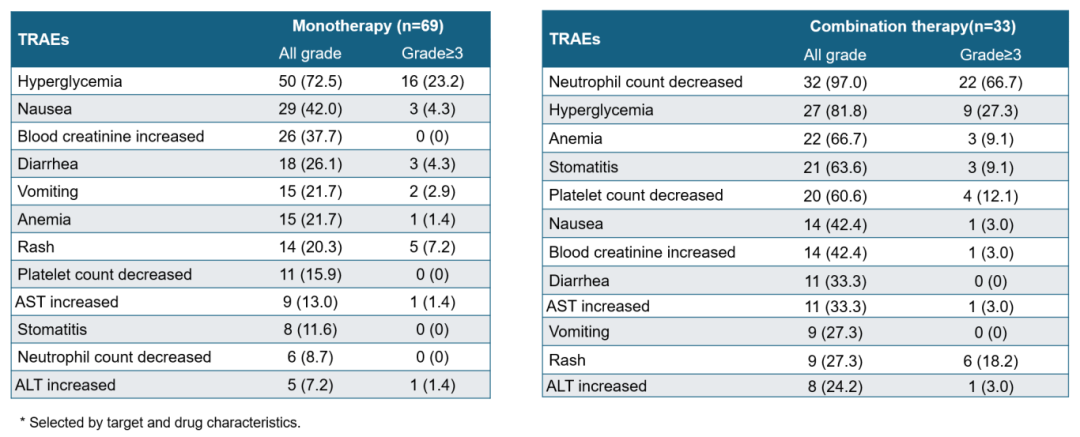
截图来源:企业官微,单药治疗(左)和联合治疗研究(右)
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx