艾伯维1类新药国内申报上市
10月13日,国家药品监督管理局药品审评中心 (CDE)官网显示,艾伯维注射用E型肉毒毒素(TrenibotE)上市申请获受理,注册分类为1类。根据公开资料和临床试验进展,推测其适应症为中度至重度眉间纹。
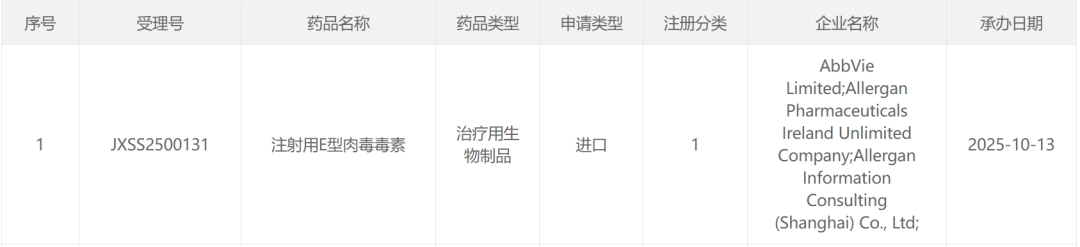 截图来源:CDE 官网
截图来源:CDE 官网
公开资料显示,TrenibotE是同类首创的E型肉毒神经毒素,2025 年4月,艾伯维向FDA提交了该产品的首个上市申请,此申请得到来自2100多名接受TrenibotE治疗患者的临床研究数据支持,其中包括两项评估TrenibotE治疗中度至重度眉间纹的关键性Ⅲ期临床研究(M21-500和M21-508)以及一项Ⅲ期开放标签安全性研究(M21-509)。
以上Ⅲ期研究的所有主要和次要终点均已达到,给药后8小时即可快速起效(最早评估时间),且疗效持续时间为2~3周。
此外,无论是作为单次治疗还是最多连续三次治疗,TrenibotE治疗中出现的不良事件与安慰剂相似。在国内,艾伯维曾针对该产品启动一项治疗中度至重度皱眉纹的Ⅲ期多中心随机安慰剂对照研究,具体研究结果尚未披露。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx