中文翻译:储旻华,来源:科睿唯安生命科学与制药
2008-2017年的十年间,六大主要监管机构_欧洲药品管理局(EMA)、美国食品药品监督管理局(FDA)、日本药品和医疗器械局(PMDA)、加拿大卫生部(Health Canada,HC)、瑞士医药管理局(Swissmedic)和澳大利亚医疗用品管理局(TGA)的监管环境有了重大改进,同时跨国药企的战略也发生了改变。
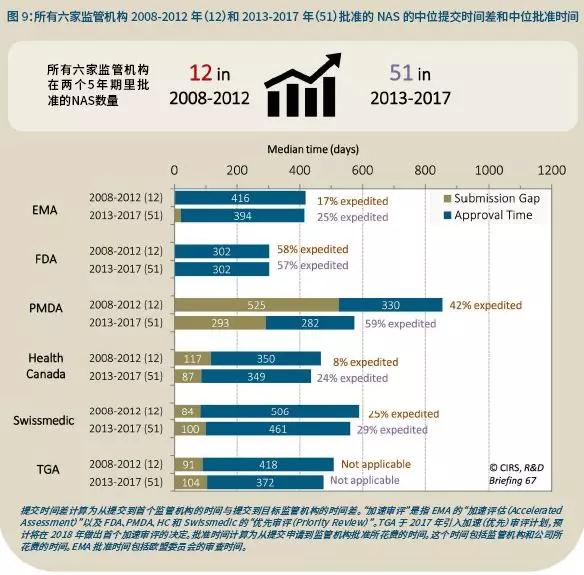
这些变化使得药物上市授权时间缩短,获批药物的数量增加。具体来说,获得所有六大监管机构批准的药物从2008-2012年的12个增加至2013-2017年的51个。
本研究分析和讨论了影响新药提交和批准所需全部时间的基本因素,包括:公司战略、审评流程的执行和类型,以及产品类型和治疗领域。
尽管如此,决定申请提交的可能性和时间点的一个关键因素是申办方的规模,这也是本篇简报的重点内容。如果一个药物由一家规模较小的公司开发,那么药物在首个国家提交申请后不太可能再去其他国家寻求上市。

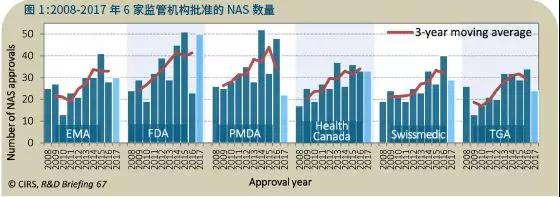
2017年,批准NAS最多的监管机构是FDA(50),其次是加拿大卫生部(30)、EMA(30)、Swissmedic(29)、TGA(24)和PMDA(22)(图1)。尽管这些数字每年都在变化,但是正如三年移动平均值所示,六家监管机构批准的NAS的总数在增加。
比较2008-2012年间以及2013-2017年两个时间段中各个监管机构批准的NAS数量,可以发现,批准数量差异最大的是TGA,增加了56%,其次是加拿大卫生部和EMA(46%)、Swissmedic(41%)、FDA(38%)和PMDA(26%)。
各个监管机构批准药物的数量呈现年度差异有很多原因,比如公司向每家监管机构提交申请的策略都是不同的,而这个策略还基于公司规模、未满足的医疗需求以及机构审评速度而变化。
另一个原因是审评时间。某些监管机构,如FDA,全年持续批准NAS;而另外一些监管机构,比如PMDA,只在一年中某些特定的时间点批准NAS。
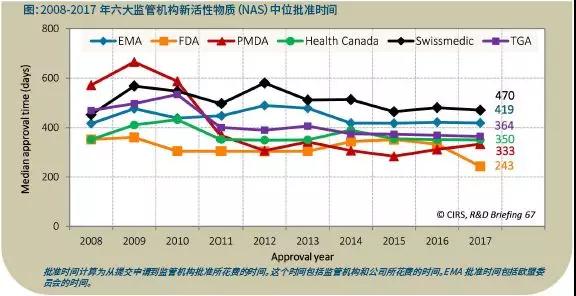
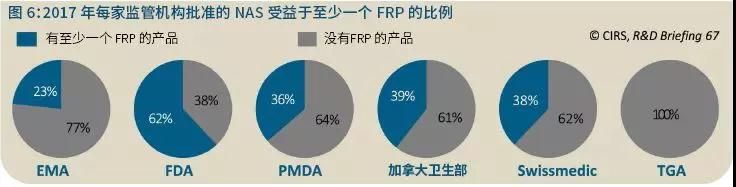
2017年,FDA是中位批准时间最短的监管机构(243天)。这可能是由于加速监管途径(FRP)在这一年被广泛使用,大约40%的NAS批准获得了突破性疗法指定,凸显了那些产品在解决未满足医疗需求上的重要性。
FDA之后各监管机构按中位批准时间由短到长排列依次是:PMDA(333天)、加拿大卫生部(350天)、TGA(364天)、EMA(419天)和Swissmedic(470天)。
整体来说,六家监管机构的中位批准时间相似,最快和最慢的机构(不包括FDA)之间的差值为137天,与过去观察到的批准时间中位值趋同的趋势一致。
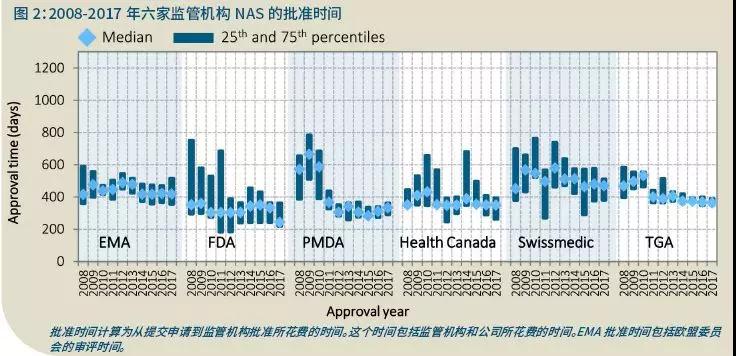
近年来各监管机构批准时间的变化也很小(25%和75%),特别是TGA、FDA、EMA和PMDA(图2)。在审评时间上则显得更为一致。这可能是多种因素造成的,比如EMA和TGA在批准程序和流程上进行立法,提高了公司提交申请的质量;各监管机构实施了多种质量措施,如提交前的工作,在审评开始前验证文档的质量,并最终提高流程的一致性和及时性。若存在差异,可能是因为该监管机构采用的是标准途径还是加速途径,以便优先审评某些NAS。
审评类型
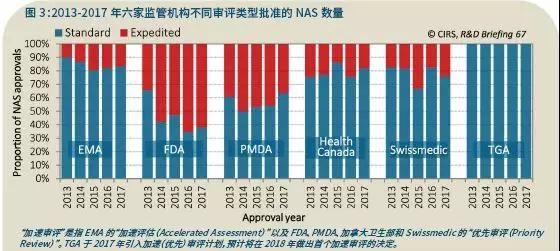
目前所有六家监管机构都已经提供加速优先审评的途径(EMA的“加速审评(Accelerated Assessment)”,以及FDA、PMDA、加拿大卫生部、Swissmedic和TGA的“优先审评(Priority Review)”),旨在加速有前景的NAS的审评过程(图3)。
TGA于2017年实施了优先审评流程,但是当年并没有授权任何加速批准 。尽管如此,该机构一直在接受优先审评的申请,预计2018年将会授权首个加速审评。
2016年,加速批准/标准批准比最高的监管机构是FDA(62%),接下来依次是PMDA(36%)、Swissmedic(24%)、HC(18%)和EMA(17%)。
过去几年中,FDA和PMDA的加速批准占比一直很高。但实际上,与2008-2012年相比,2013-2017年所有五家监管机构都增加了加速批准的比例(数据未显示)。EMA的增幅最大,从2008-2012年的7%增加至2013-2017年的16%;其次是Swissmedic(10%至22%)、PMDA(22%至45%)、FDA(43%至55%)和加拿大卫生部(18%至21%)。
EMA加速批准比例的大幅增长可能是该机构2015年修订加速评估(Accelerated Assessment)指南的结果,更新版的指南希望能优化公司对这个工具的使用。
尽管如此,还需要更多的时间来确定EMA的优先审评(Priority Review)途径的使用是否会进一步的增加,特别是2016年该机构推出了优先药物计划(PRIME),该计划专门用于促进加速评估用于旨在解决未满足医疗需求的药物。
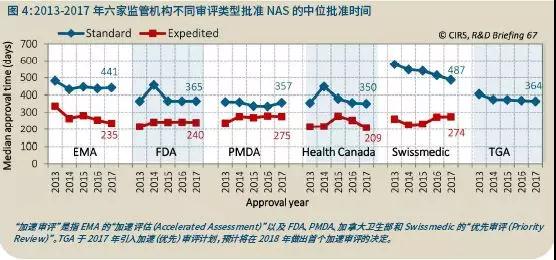
2017年,Swissmedic以标准流程批准NAS的中位批准时间连续第五年减少,自2013年以来下降了91天。
Swissmedic也是2017年加速审评和标准审评中位批准时间差异最大的监管机构,差距为213天(图4)。差距最小的是PMDA,82天;其他监管机构的时间差是:EMA 206天,加拿大卫生部141天,FDA 125天。TGA于2017年引入了优先审评,审评时间150天(仅指监管机构的时间),与EMA相同,未来该机构应该会与其他监管机构一样,为重要产品提供加速批准的机会。
特点:加速监管途径
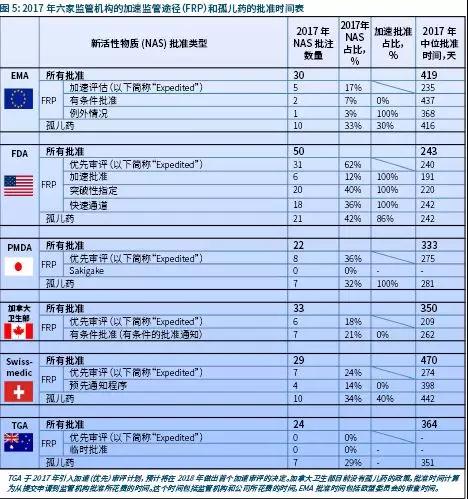
六家监管机构中,FDA提供了最多的加速监管途径(FRP),用于提供、审评和/或批准解决未满足医疗需求的药物(图5)。
2017年,FDA批准的NAS中62%受益于至少一种可用的FRP,而其他监管机构这一比例在20%-40%(图6)。2017年,在五家监管机构的各种FRP中,FDA加速评估途径的中位批准时间最快(191天)。然而,应当注意的是,FDA审评的很多药物享有多个FRP,这通常会使得批准时间更快。TGA在这一年引入了临时批准(Provisional Approval)途径,该途径将基于早期临床数据为有前景的药物提供专门的注册流程。
特点:治疗领域
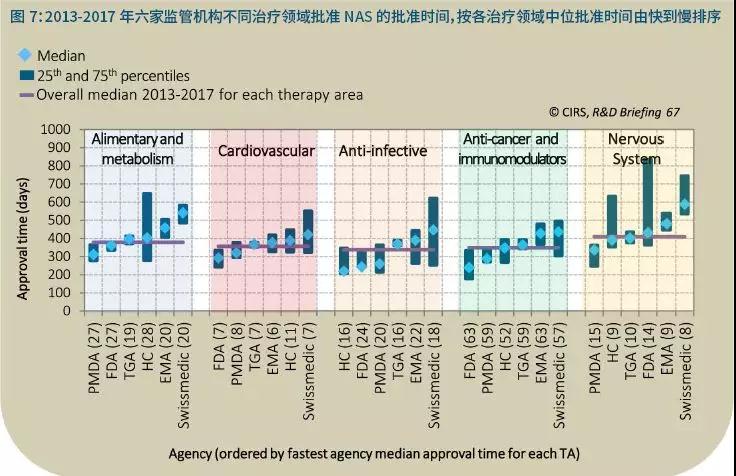
2013-2017年,所有六个监管机构批准抗感染NAS的速度都略有加快,总体中位批准时间338天。与之相比,抗癌药和免疫调节为349天,心血管药物357天,消化和代谢药物379天,神经系统药物409天。
所有五个治疗领域中,有三个批准时间最快的两家监管机构都是PMDA和FDA(图7),分别是消化和代谢、心血管以及癌症和免疫调节药物。
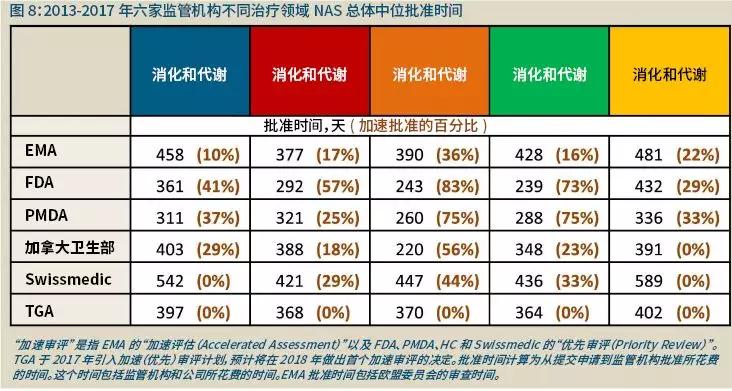
这可能反映出那些治疗领域使用加速批准途径更为频繁(图8)。然而,正如25和75百分位数值所显示的那样,某些监管机构在同一治疗领域的批准时间也存在非常大的差异。
比如加拿大卫生部和FDA在神经系统NAS的批准时间上差异很大,而在抗感染、心血管以及抗癌和免疫调节药物上只有很小的差别。对于同一个治疗领域,六家监管机构的批准时间也有区别,如在抗感染以及抗癌和免疫调节这两个治疗领域,这可能是由于六家监管机构在使用加速途径上的区别。
常规批准:六家监管机构
研究所有六家监管机构批准的产品可以真正地比较它们的监管绩效。分析比较了过去十年的两个时间段:2008-2012年和2013-2017年,以确定是否有一些趋势存在。
有趣的是,被所有六家监管机构都批准的药物总数从2008-2012年的12个增加至2013-2017年的51个,这说明在同一时间段里有更多的产品正变得国际化。
影响NAS注册的多个潜在因素可能决定了注册时间的总长度,包括提交时间和批准时间(图9)。这些因素包括公司在特定监管机构提交的策略,或者设定的批准时间点。而NAS的类型,以及监管机构为有前景的药物所提供的旨在解决未满足医疗需求的加速途径反过来又影响了这些因素。
两个时间段注册时间最快的监管机构都是FDA,原因包括公司选择首先在FDA提交注册,以及FDA的快速监管审评。提交到EMA的时间几乎和FDA同步,该机构的注册总体时间在减少,这可能反映了EMA对重要产品增加了加速途径的使用。EMA和FDA之后,提交到加拿大卫生部、Swissmedic和TGA的时间差大约为80-100天,在两个时间段不尽相同。
虽然时间差最大的是PMDA,但是与2008-2012年相比,2013-2017年提交时间差减少了大约一半,批准时间也有大幅的减少,这可能反映出该机构更广泛地使用了加速审评。这也显示出PMDA在加速药物审评上的努力,该机构最显著的变化包括增加了资源,引入了讨论临床试验结果的事前评估会议,以及在新药申请提交前大约6个月开展事前评估咨询。
EMA批准流程的特点
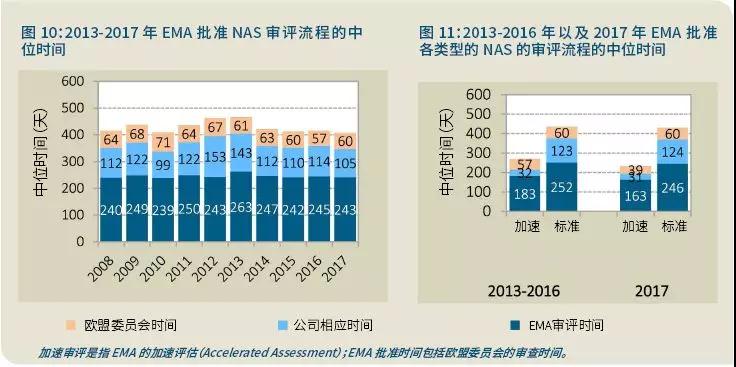
从2012年起EMA的总体中位批准时间减少,这很大原因是由于公司响应时间的减少(图10)。
此外,NAS加速批准和标准批准的中位时间的重要差异导致欧盟委员会时间的减少:2013-2016年是57天,而2017年是39天(图11)。
另外,比较2012年和2017年的数据(图10)可以发现,总体而言,公司响应时间的中位值减少了48天;EMA的中位审评时间在2012年和2017年都是243天(虽然2013-2016年期间有一些变化);欧盟委员会的时间从2012年到2017IA小幅减少了7天。整体上,EMA的加速审评大约能将审评时间加快1.4-1.5倍,这是因为减少了人用药品委员会(CHMP)的给出审核意见的规定时间(120天取代了150天)。
加速审评的特点还包括,在这两个时间段里,公司的响应速度快了大约4倍(图11)。这是由于立法规定了公司的响应时间限定,如果超出一个月,EMA可以决定将评估转回标准审评。
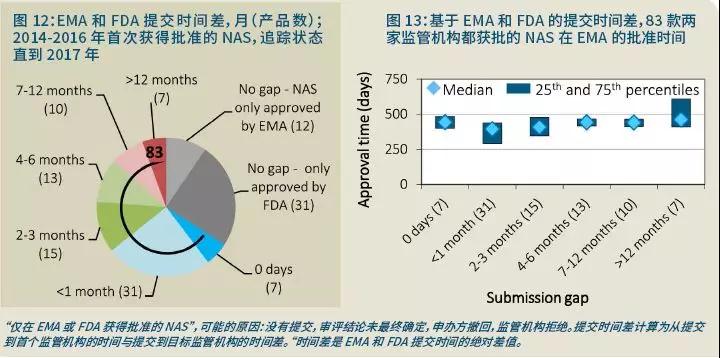
分析仅获得EMA或FDA批准,或者获得两家机构批准的产品后发现,2014-2016年FDA批准的NAS中有31个到2017年末还未获得EMA的批准(原因包括未提交申请,审评结论未最终确定,申办方撤回,或EMA拒绝)。
同样,2014-2016年首先获得EMA批准的NAS中有12个到2017年末还未获得FDA的批准。83个NAS获得了这两家机构的批准,最常见的提交时间差是一个月(图12)。
然而,与FDA相比,最常的产品提交时间差75百分位超过12个月。有趣的是,对于其他监管机构批准后超过一个月才在EMA获得批准的NAS,2016年的时间差是34天,而2017年是91天。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx