近年来,生物药研发日趋火热,然而,统计发现全球药品研发中化学药品新药主体地位依然不可撼动,全球161个近5年批准化药 (全球主要指美国、欧盟、日本和中国地区)中,生物药只是占有66个。
中国医药市场在世界范围内举足轻重,然而,一直以来,中国新药审评审批之路十分漫长,饱受诟病,低效的新药审评审批制度限制着医药企业的创新性,拉慢了安全有效新药的上市速度,严重阻碍着中国医药市场的国际化进程。自2015年8月,国务院启动新一轮新药审评审批制度改革,改革成效初步显现,统计显示:截至2016年9月底,已完成审评任务8868件,是2015年同期的2倍。积压的注册申请已由近22000件降至现在的11500件,这无疑是一个巨大的进步。
一. 中国医药行业的痼疾
多年来,中国医药企业创新性不高,企业新药研发能力与美国及其他发达国家相比还存在比较大的差距。据统计,2004-2014年间,CFDA共批准183个新分子实体,其中仅仅34个国内制药企业申报的创新药。医药行业存在如下情况:1.中国化学药的注册申请仍旧占据重要地位;2.企业创新能力不足、规模小,缺乏重磅产品,某些中药取得一定成果;3.化药注册申请中,1.1类新药大多数为低水平的me-too类药物开发;4. 3类新药研发日趋成熟,企业日益重视,目前3类药品具有广阔的市场前景;5.存在严重的重复建设,某一种仿制药,重复申请严重,而真正安全有效、临床急需的创新药却无法快速上市,漫长的审评审批程序影响患者切身利益。
二. 中国漫漫审批之路
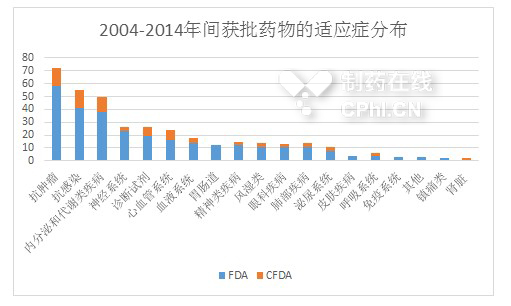
一般说来,对于进口药的审评,审批注册流程大约需要5年,其中1. IND审批平均需要11个月,2. NDA审批时间大约需要20个月,3. CFDA验证性临床试验审查平均花费28个月,这其中最耗时的是验证性临床试验的设计和开展。数据显示,2004年至2014年间,FDA总计批准291个新分子实体(New molecular entity),相比较而言,中国CFDA总计批准了291个中的79个,CFDA/FDA批准药物的适应症分布见下图。
三. 陪跑CFDA,考验医药研发企业
低效、缺乏灵活性的审评审批制度阻碍着具有研发实力医药企业的发展壮大,统计显示,CFDA药物审评审批平均滞后FDA 3年,据记录,市场上一款慢性肾脏病患者继发性甲状旁腺功能亢进治疗药物审批通过时间竟滞后FDA 10年;某些癌症创新性药物,如erlotinib ,bevacizumab, lapatinib and dasatinib,平均滞后FDA 5年。鉴于篇幅限制,各种药物详细的FDA/CFDA提交及审批滞后之间对比此处不再列举。
中国正处于深化改革的关键时刻,中国医药研发格局同样经历深刻的变化,2015年8月开启的新一轮药品审评审批改革中,亮点颇多,成果初显。推进临床数据自查核查,提高药物审评审批费用,严格推进仿制药物一致性评价进程,积极开展上市许可人制度的试点,加快创新药审评审批,加快审评审批防治艾滋病、恶性肿瘤、重大传染病、罕见病等疾病的创新药,列入国家科技重大专项和国家重点研发计划的药品,转移到境内生产的创新药和儿童用药,以及使用先进制剂技术、创新治疗手段、具有明显治疗优势的创新药。这些举措都在一定程度上缓解了注册积压,并刺激了医药企业创新能力,体现了CFDA新药审评审批的灵活性转变。
来源:CPHI
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx