根据《中华人民共和国药品管理法》《药品生产监督管理办法》及相关规范要求,药用辅料质量安全直接关系到药品制剂的有效性与安全性。2026年1月16日,河北省药品监督管理局率先发布《河北省药用辅料生产企业主体责任清单》,成为全国首个省级药监部门针对药用辅料生产质量安全主体责任开展专项自查自纠工作的指导性文件,标志着药用辅料生产监管进入更加严格、规范的新阶段。
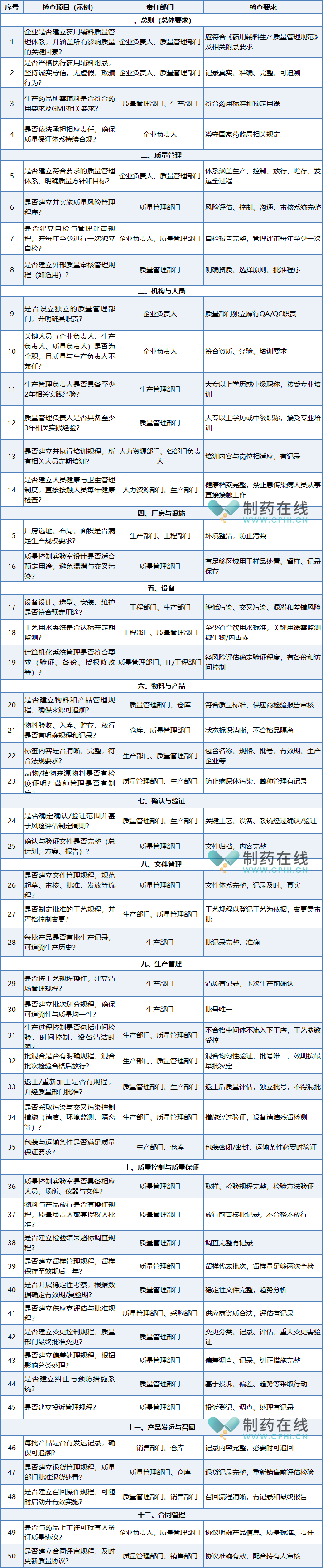
该清单围绕药用辅料生产企业质量安全主体责任,系统梳理了从质量管理、机构人员、厂房设施到生产控制、质量保证等全环节的关键要求,旨在推动企业全面自查、及时整改,切实落实“四个最严”监管精神。为协助MAH更好地履行对辅料供应商的审核与管理职责,本文结合清单内容与现场检查实践,对重点检查项目及常见风险点进行梳理分析,供MAH在迎接飞行检查、开展供应商审计及内部自查自纠时参考借鉴。
药品上市许可持有人(MAH)作为药品质量安全的第一责任人,在药用辅料生产质量安全主体责任自查自纠工作中承担着关键的监督与协调职责。为确保相关要求落到实处,MAH应主动配合监管部门及辅料生产企业,系统推进风险管理工作,着力防范化解质量隐患。针对自查或外部检查中发现的重大缺陷项目,必须立即采取有效的风险控制措施,防止问题扩散,确保药品生产质量体系持续合规。
为协助MAH系统开展迎检前自查工作,以下对照《药用辅料生产质量管理规范》及相关附录,结合药监机构最新监管要求,梳理形成各环节主要自查清单。实际运用中,请持有人结合企业具体生产品种、工艺特点及现行法规动态,对清单内容进行适应性调整与细化,对应每个要素主要自查清单如下:
参考文献:
河北省药品监督管理局官网
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx