首个司美格鲁肽鼻喷雾剂国内获批临床
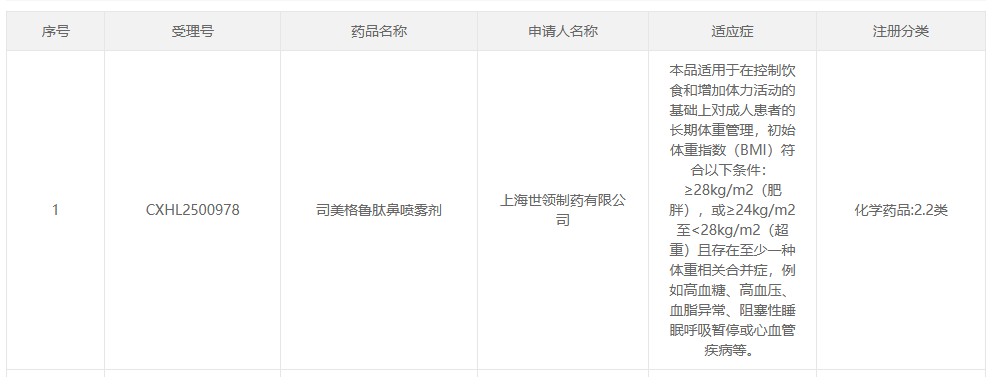
2026年1月12日,国家药监局药审中心(CDE)官网显示,世领制药申报的司美格鲁肽鼻喷雾剂获批临床,适用于在控制饮食和增加体力活动的基础上对成人患者的长期体重管理,初始体重指数(BMI)符合以下条件:≥28kg/m2(肥胖),或≥24kg/m2至<28kg/m2(超重)且存在至少一种体重相关合并症,例如高血糖、高血压、血脂异常、阻塞性睡眠呼吸暂停或心血管疾病等,注册分类为2.2类。
据官方新闻稿,这也是全球首款GLP-1经黏膜递送制剂。
截图来源:CDE官网
公开资料显示,世领制药的司美格鲁肽是基于黏膜递送平台开发的一款鼻喷雾剂,其优势在于:避免首过效应,提高生物利用度;无创给药,依从性极高,更利于疾病的治疗和管理;用药便捷,可自我给药。
恩沃利单抗新适应症申报上市
近日,CDE官网显示,恩沃利单抗注射液新适应症申报上市,联合吉西他滨和奥沙利铂(GEMOX)方案,用于一线治疗不可切除或转移性胆道癌。

截图来源:CDE官网
此次新适应症上市申请获受理是基于Ⅲ期临床试验KN035-CN-005的积极结果。这是一项针对中国晚期一线胆道癌患者设计的随机、平行对照、多中心Ⅲ期研究,旨在评估恩沃利单抗联合GEMOX方案对比单纯 GEMOX方案的疗效与安全性。具体的研究结果尚未披露。
据悉,恩沃利单抗是康宁杰瑞和思路迪医药合作研发的全球首个皮下注射PD-L1抗体药物,在便利性和安全性方面具有显著优势,患者无需进行静脉滴注,可以在30秒内完成给药,尤其适用于体弱、高龄及有静脉输注反应的患者。
礼来减重小分子新药国内申报上市
近日,CDE官网显示,礼来申报的1类新药奥氟格列隆片(Orforglipron)上市申请获受理。值得一提的是,2025年12月礼来在新闻稿中透露,已向美国FDA提交了Orforglipron用于治疗成人肥胖或超重的新药申请,并且该药已经获得FDA颁发的国家优先凭证,可能会提前获批。

截图来源:CDE官网
公开资料显示,Orforglipron是一种在研的、每日一次口服的小分子(非肽类)胰高血糖素样肽-1受体激动剂(GLP-1 RA)。该药物可在全天任何时间服用,对饮食和饮水不加以限制。
目前,礼来正在进行Orforglipron用于治疗2型糖尿病,以及用于肥胖或至少伴有一种体重相关合并症的超重成人进行体重管理的系列Ⅲ期研究。此外,礼来还在研究Orforglipron作为治疗肥胖成人的阻塞性睡眠呼吸暂停、高血压及骨关节炎疼痛的潜在可能。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx