III 期临床启动,意味着新药研发已经开始向上市申请发起冲刺。
2025 年 3 月(数据范围 3.1-3.28),多款国产创新药迈出重要步伐,首次启动 III 期临床。这些新药进展来自信达、恒瑞、翰森、百利天恒等企业,本文从中选择部分重点项目跟大家分享。

翰森 HS-20089
全球首个进入 III 期临床的 B7-H4 ADC
3 月 3 日,翰森在国内启动了一项多中心、随机、开放、对照、III 期临床研究,旨在对比 HS-20089 和研究者选择的化疗治疗复发上皮性卵巢癌的有效性、安全性和耐受性;同时评价该药的药代动力学特性和免疫原性。

截图来源:Insight 数据库
HS-20089 是一种新型 B7-H4 ADC,带有拓扑异构酶抑制剂 (TOPOi) 有效载荷。B7-H4 是 B7 超家族中的跨膜糖蛋白,在正常组织中的表达有限,但在各种癌症中高度表达。2023 年 10 月,GSK 和翰森就该药达成独家许可协议,GSK 获得该药全球独家权利(中国大陆、香港、澳门和台湾除外),以推进 HS-20089 的开发和商业化。根据该协议条款,翰森将获得 8500 万美元的预付款,并有资格获得高达 14.85 亿美元的里程碑收益。在 HS-20089 商业化后,GSK 还将根据中国大陆、香港、澳门和台湾以外的全球净销售额支付分级特许权使用费。Insight 数据库显示,全球范围内共有 8 条 B7-H4 ADC 管线在研(仅统计积极状态),5 款产品进入临床阶段。其中翰森 HS-20089 进展最快,是首个进入 III 期临床的 B7-H4 ADC,其余均处于临床早期阶段。 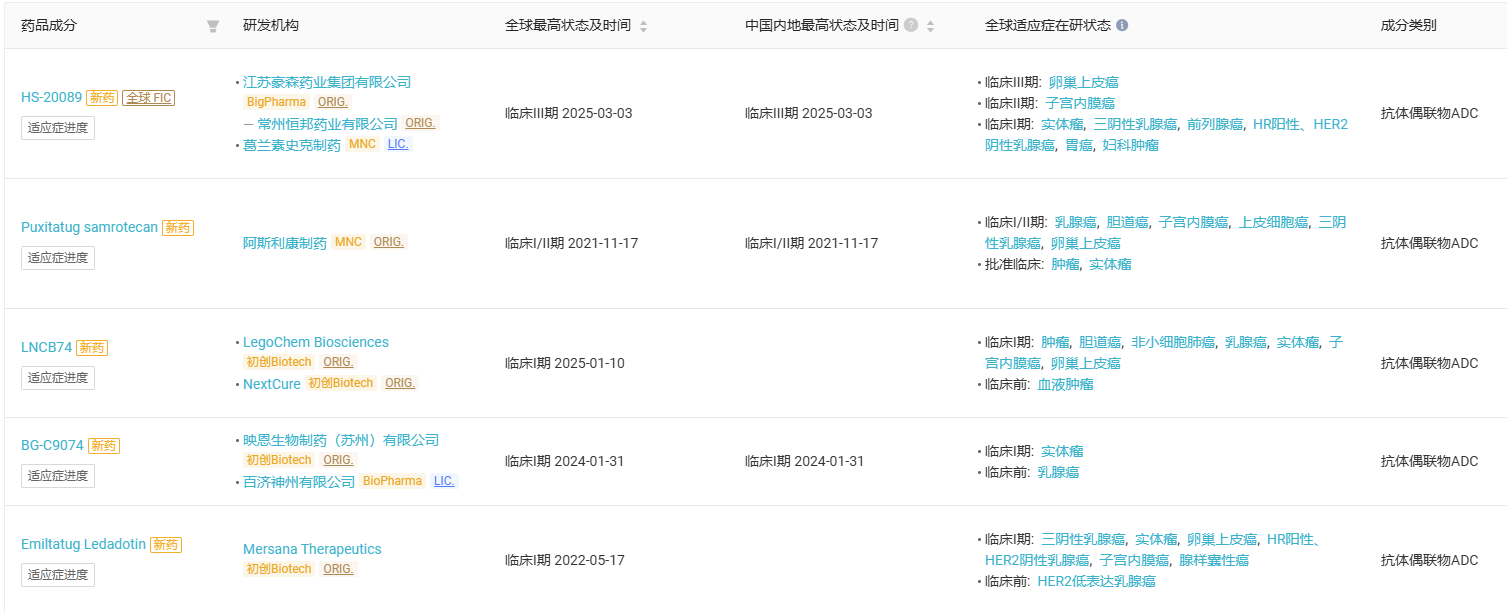
截图来源:Insight 数据库

恒瑞 夫那奇珠单抗
启动第 4 项 III 期临床
3 月 3 日,恒瑞在国内启动了一项随机、双盲、多中心、安慰剂对照 III 期临床研究,旨在成人活动性放射学阴性中轴型脊柱关节炎患者中评价 SHR-1314(夫那奇珠单抗)注射液的疗效和安全性。

截图来源:Insight 数据库
SHR-1314 是恒瑞医药自主研发的一种靶向人 IL-17A 的重组人源化单克隆抗体,于 2024 年 8 月在国内首次获批上市,用于治疗适合接受系统治疗或光疗的中重度斑块状银屑病成人患者。恒瑞对于该药的布局并不仅限于此,SHR-1314 用于治疗常规治疗疗效欠佳的活动性强直性脊柱炎成人患者适应症的上市申请已获 CDE 受理。Insight 数据库推测该适应症将于 2025 年 Q2 获批。Insight 数据库显示,国内目前已有 5 款 IL-17A 单抗获批,分别为司库奇尤单抗(诺华)、依奇珠单抗(礼来)、比吉利珠单抗(优时比)、赛立奇单抗(智翔金泰)、夫那奇珠单抗(恒瑞)。此外,国内还有 3 款 IL-17A 单抗已进入上市申请阶段,分别来自百奥泰、康方和三生国健。其中百奥泰为一款司库奇尤单抗生物类似药。 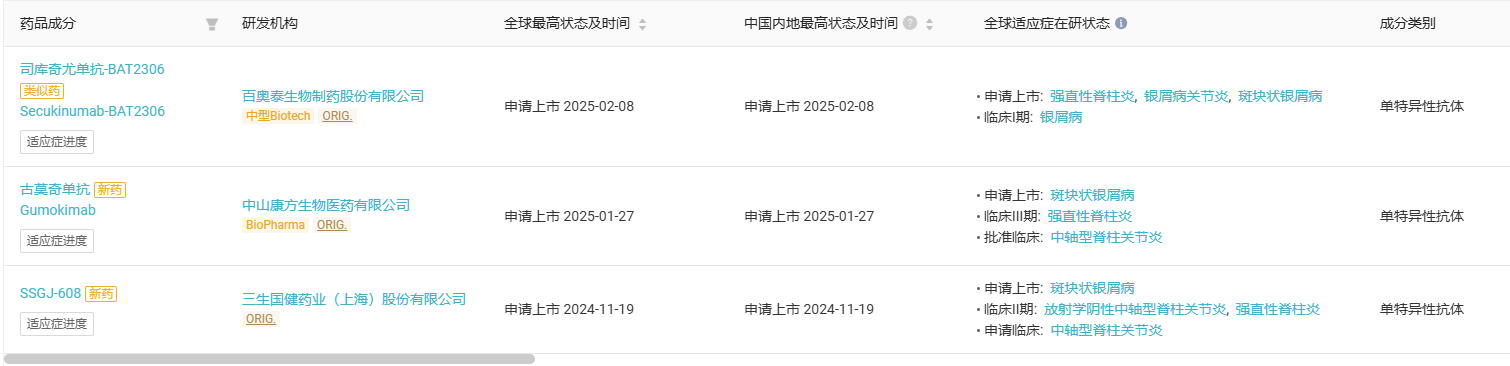
截图来源:Insight 数据库

百利天恒 伦康依隆妥单抗
启动第 9 项 III 期临床试验
3 月 4 日,百利天恒在国内启动了一项在既往经含铂化疗及 PD-1/PD-L1 抑制剂治疗失败的不可手术切除的局部晚期或转移性尿路上皮癌患者中对比 BL-B01D1(伦康依隆妥单抗)与医生选择的化疗方案 III 期随机对照临床研究。

截图来源:Insight 数据库
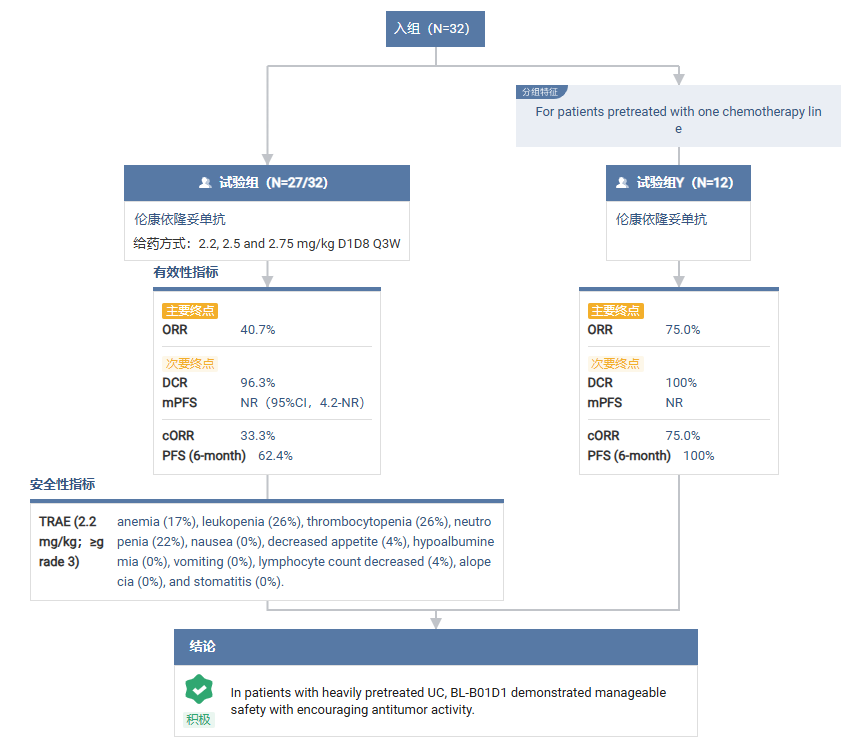
BL-B01D1 是一款同类首创 EGFR/HER3 双抗 ADC,包含稳定的、可切割的连接子和拓扑异构酶抑制剂。目前该药已经开展鼻咽癌、食管鳞癌、乳腺癌、非小细胞肺癌等多个 III 期临床。2023 年 12 月,百利天恒以 8 亿美元首付款,潜在总交易额最高达 84 亿美元,将 BL-B01D1 授权给 BMS,刷新国产 ADC 新药出海授权新纪录。根据协议,百利天恒将保留该药在中国大陆的独家权益,而 BMS 将获得其在全球其他市场的独家许可。在 2024 年 ESMO 大会上,百利天恒公布了 BL-B01D1 在尿路上皮癌(UC)中的 I 期研究数据。截至 2024 年 4 月 29 日,共有 32 名 UC 患者入组 Q3W 治疗方案,其中 29 名患者接受 2.2 mg/kg 治疗,2 名患者接受 2.5 mg/kg 治疗,3 名患者接受 2.75 mg/kg 治疗,既往系统治疗线数中位数为 2。结果显示:入组患者中,23 名接受 2.2 mg/kg 治疗的患者可评估疗效,ORR 为 43.5%,cORR 为 34.8%,DCR 为 91.3%,mPFS 为 5.5 个月。
截图来源:Insight 数据库
Insight 数据库显示,目前全球范围内共有 4 款 EGFR/HER3 ADC 进入临床阶段,分别是 BL-B01D1(百利天恒)、JS212(君实)、BL-B16D1(百利天恒)和 IBI3005(信达),全部为国产。值得一提的是,百利天恒拥有 2 款 EGFR/HER3 ADC,两款采用了不同的毒素,BL-B01D1 使用喜树碱衍生物:ED04,而 BL-B16D1 使用微管蛋白抑制剂。

信达 玛仕度肽
启动第 6 项 III 期临床试验
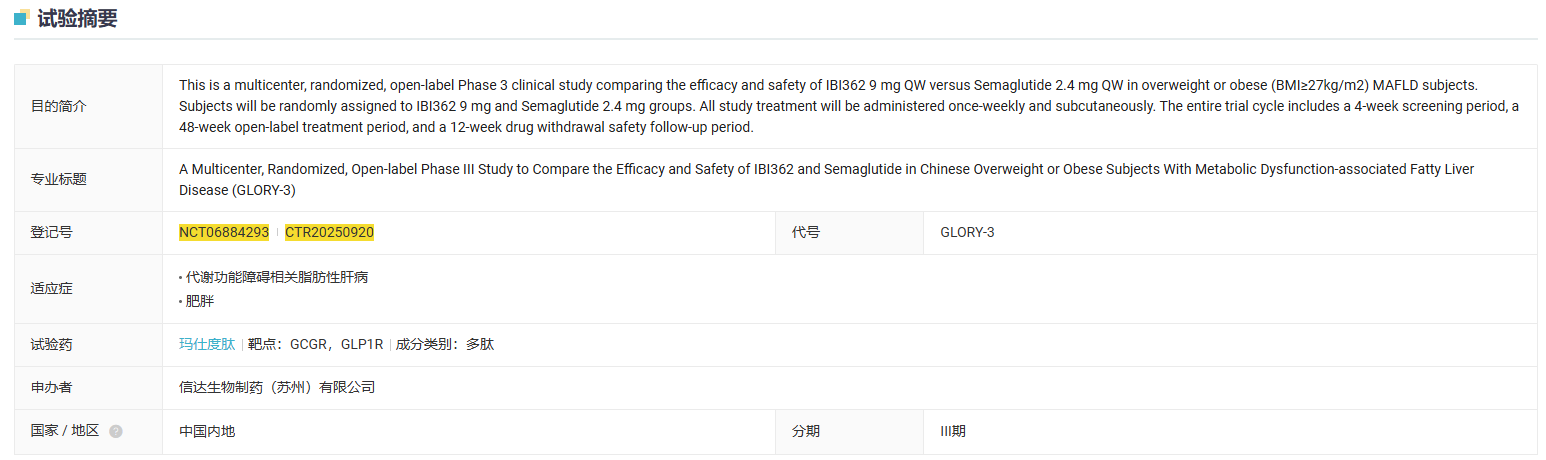
3 月 14 日,信达在国内启动了一项多中心、随机、开放标签的 III 期临床研究(GLORY-3),旨在中国超重或肥胖合并代谢相关脂肪性肝病(MAFLD)受试者中比较玛仕度肽(IBI362)与司美格鲁肽有效性和安全性。
截图来源:Insight 数据库
玛仕度肽是信达生物与礼来制药共同推进的一款胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂。
截至目前,玛仕度肽已经启动 6 项 III 期临床,涉及 2 型糖尿病、肥胖以及 MAFLD,其中 GLORY-1、DREAMS-1 和 DREAMS-2 研究均已达成终点。值得一提的是,该药当前共有 2 项 NDA(肥胖/2 型糖尿病)获 NMPA 受理审评中,预计本年陆续获批减重和 T2D 两项适应症。 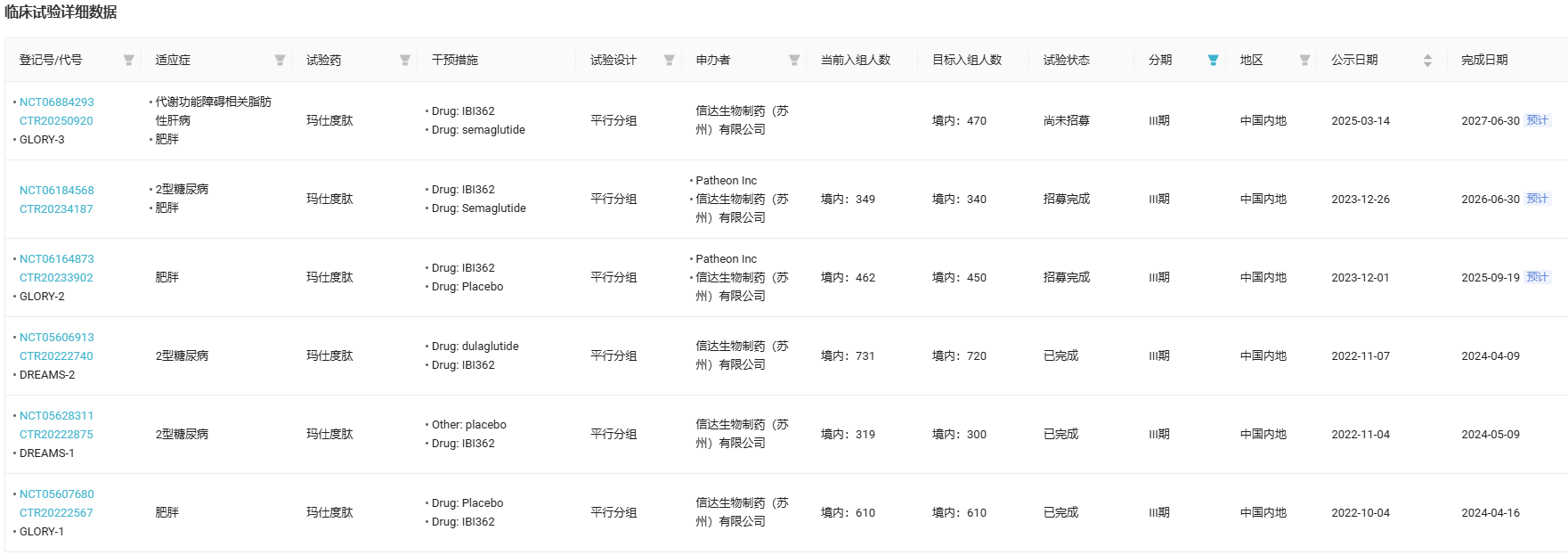
截图来源:Insight 数据库
Insight 数据库显示,全球范围内共有 15 条 GLP-1R/GCGR 双重激动剂在研,玛仕度肽是其中研究进展最快的。除此之外,一款来自 Zealand Pharma/BI 的 Survodutide 已进展到 III 期临床。另外还有 6 款同靶点双重激动剂已经启动 II 期临床。

截图来源:Insight 数据库
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx