2022年12月30日,国家卫生健康委医政医管局网站发布《新型抗肿瘤药物临床应用指导原则(2022年版)》,成文时间2022年12月29日,这是国家卫生健康委为进一步规范新型抗肿瘤药物临床应用,提高肿瘤合理用药水平,保障医疗质量和医疗安全,维护肿瘤患者健康权益。2018年制定了第一版,这是本指导原则的第四次更新,涵盖呼吸系统、消化系统、泌尿系统、乳腺癌、血液、皮肤、骨与软组织、头颈部、生殖系统等肿瘤的用药及每种药物的用药注意事项,本文梳理了与2021年版相比有哪些变化?
PART.01
《新型抗肿瘤药物临床应用指导原则》沿革
我国首版《新型抗肿瘤药物临床应用指导原则》发布于2018年9月21日,由国家卫生健康委组织合理用药专家委员会共同编制的我国首版《新型抗肿瘤药物临床应用指导原则(2018年版)》(国卫办医函〔2018〕821号)发布实施,自发布后每年根据国家药监局新批准抗癌药物的适应证进行持续更新,成为目前国内肿瘤医生、患者治疗用药参考最全面的“标杆指南”之一。
第二版:2019年12月20日发布2019年版。
第三版:2020年12月30日发布2020年版。
第四版:2021年12月27日发布2021年版。
第五版:2022年12月30日发布2022年版。
PART.02
新旧版《新型抗肿瘤药物临床应用指导原则》对照看
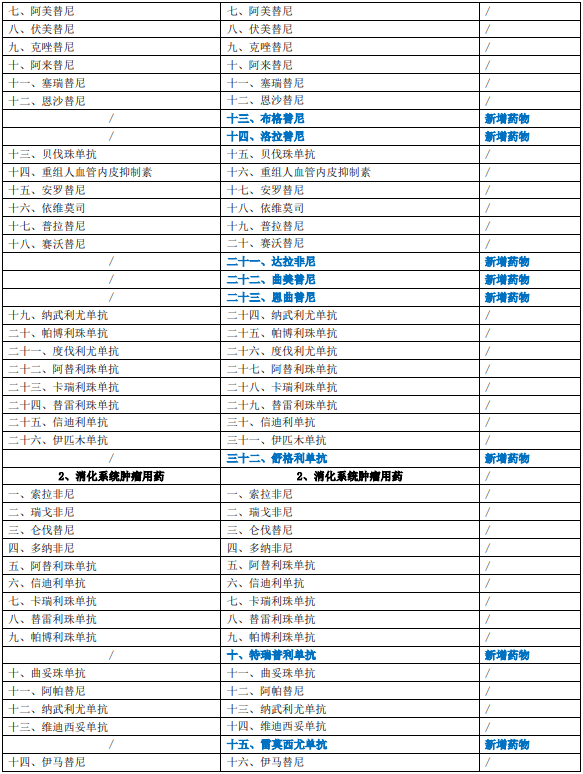
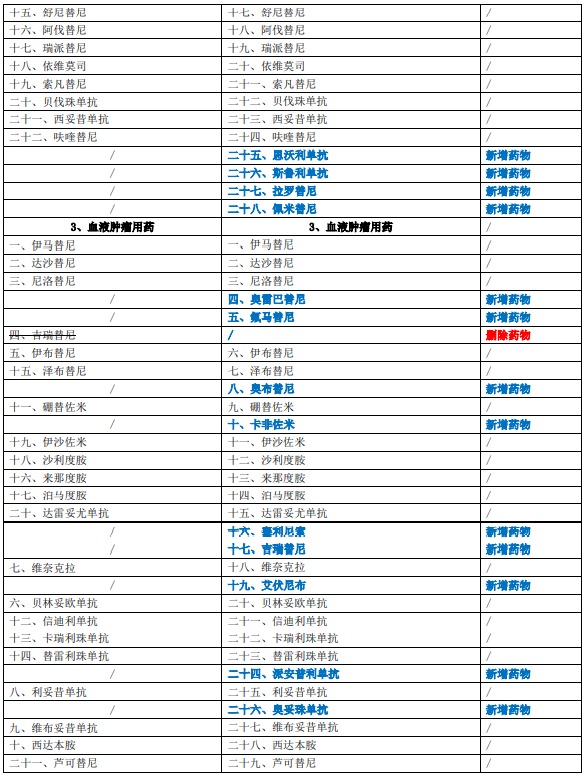
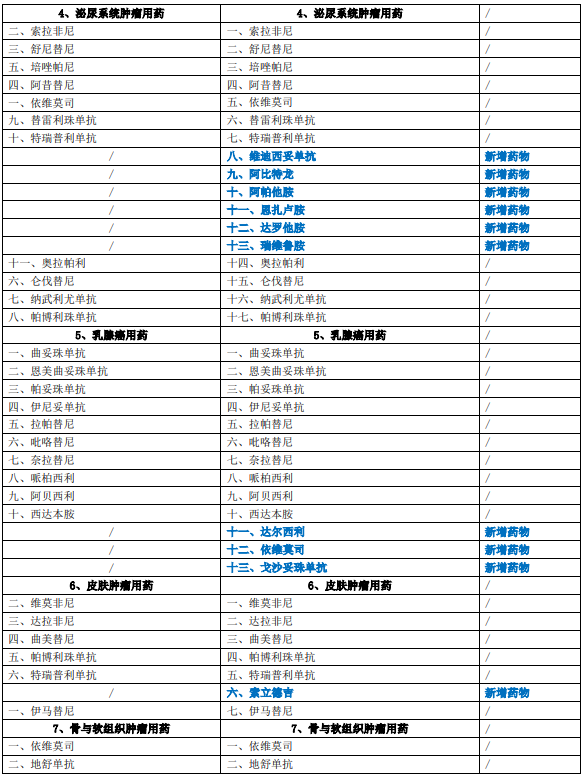
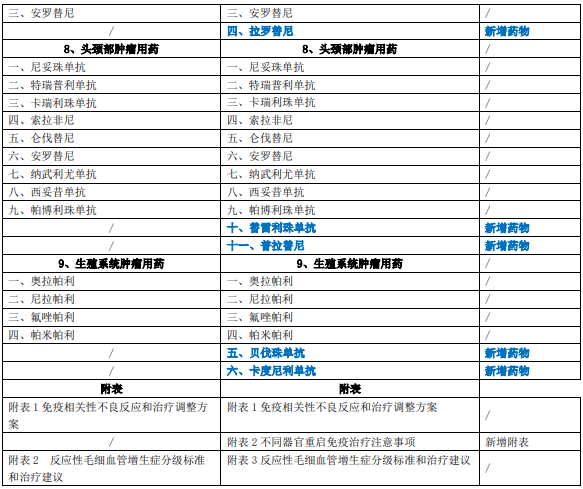
《新型抗肿瘤药物临床应用指导原则(2022年版)》共涉及呼吸系统肿瘤、消化系统肿瘤、血液肿瘤、泌尿系统肿瘤、乳腺癌、皮肤肿瘤、骨与软组织肿瘤、头颈部肿瘤、生殖系统肿瘤九大类肿瘤用药,在2021年版基础上新增药物35个(含同一药物拓展适应证),删除药物1个(血液肿瘤用药-吉瑞替尼),第一部分新型抗肿瘤药物临床应用基本原则第二节变更标题名称,新增附录表2详见下表:

PART.03
常见抗肿瘤靶向药物对照看
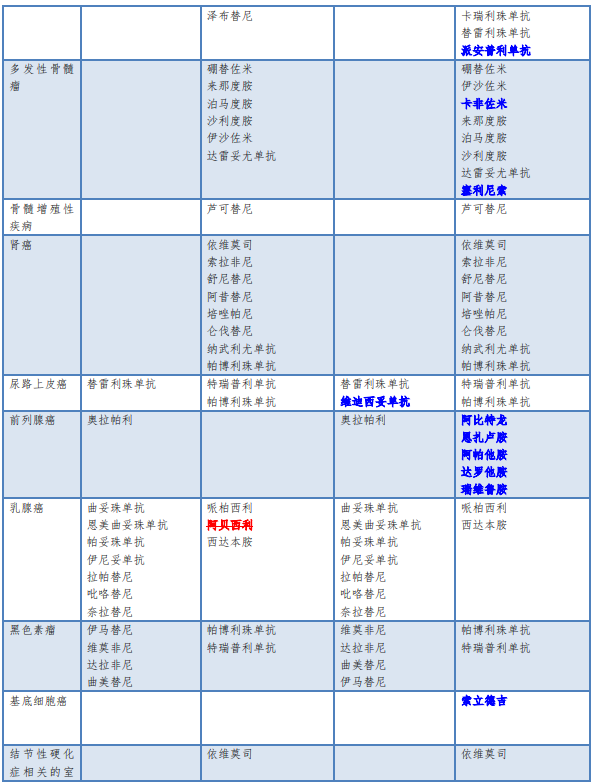
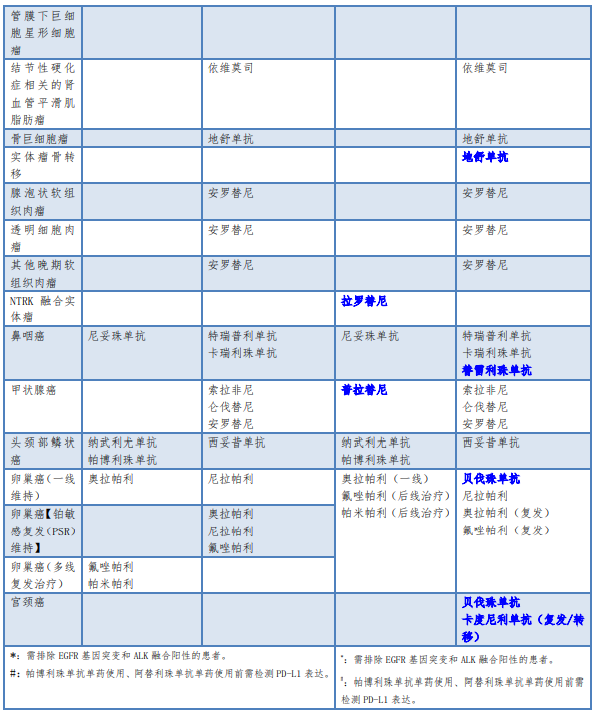
对于明确作用靶点的药物,须遵循靶点检测后方可使用的原则。检测所用的仪器设备、诊断试剂和检测方法应当经过国家药品监督管理部门批准,特别是经过临床试验伴随诊断验证的方法。不得在未做相关检查的情况下盲目用药。根据是否需要做靶点检测,可以将常用的小分子靶向药物和大分子单克隆抗体类药物分为两大类。《新型抗肿瘤药物临床应用指导原则(2022年版)》在2021年版基础上新增病种6个(高度微卫星不稳定型实体瘤、NTRK融合实体瘤、胆管癌、基底细胞癌、实体瘤骨转移、NTRK融合实体瘤、宫颈癌),2022版将卵巢癌【铂敏感复发(PSR)维持】、卵巢癌(一线维持)和卵巢癌(多线复发治疗)三个瘤种统称为卵巢癌,具体变化详见下表(蓝色加粗字体代表新增的,红色字体加删除线代表新版删除的):


PART.04
不同器官重启免疫治疗注意事项
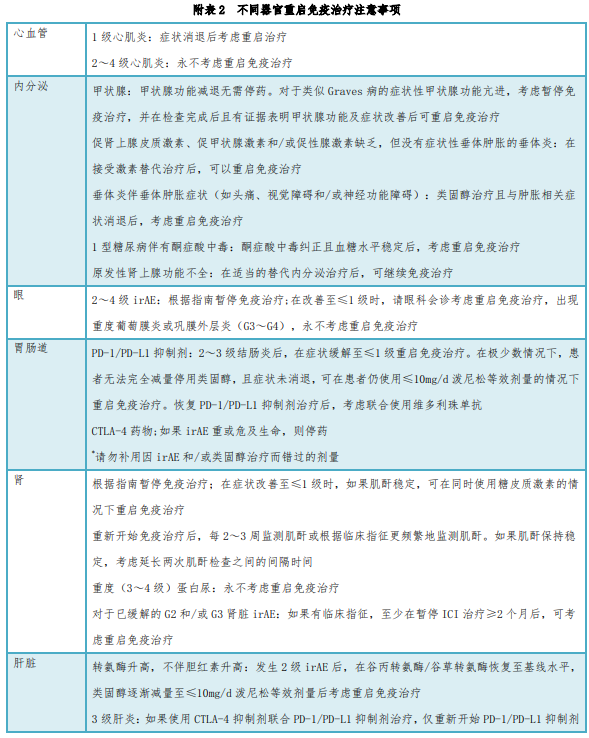
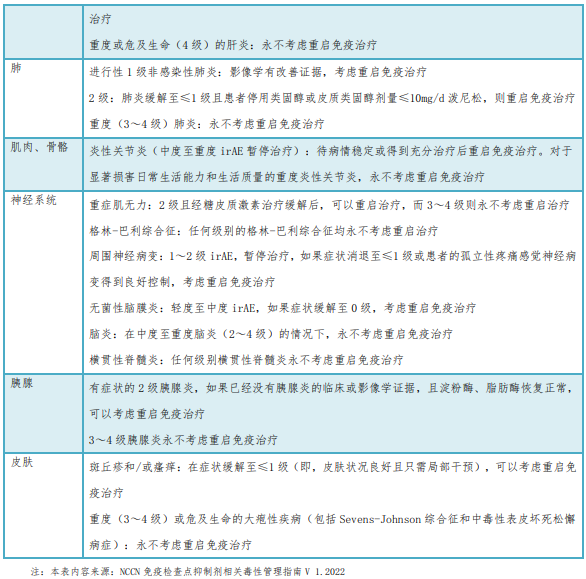
《新型抗肿瘤药物临床应用指导原则(2022年版)》新增附表2“不同器官重启免疫治疗注意事项”,多维度规范药物使用,详见下表。
参考文献
[1] http://www.nhc.gov.c
如果这篇文章侵犯了您的权利,请联系我们。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx