辉瑞利妥昔单抗生物类似药获 FDA 批准
7 月 24 日,辉瑞宣布其 Ruxience(rituximab-pvvr,利妥昔单抗)已获美国 FDA 批准。
该药是罗氏品牌药美罗华(Rituxan,通用名:rituximab,利妥昔单抗)的生物仿制药,用于成人患者治疗:非霍奇金淋巴瘤、慢性淋巴细胞白血病、肉芽肿伴多血管炎、显微镜下多血管炎。
Ruxience 是今年以来继 Trazimera(trastuzumab-qyyp,曲妥珠单抗)和 Zirabev(bevacizumab-bvzr,贝伐单抗)之后获 FDA 批准的第三个肿瘤学单抗类生物仿制药。
拜耳「利伐沙班」被判专利无效
7 月 18 日,国家知识产权局发布无效宣告请求审查决定书,拜耳知识产权有限责任公司的申请号/专利号为「200480035106.X」的专利「用于制备可口腔给药的固态药物组合物的方法」,被决定为「宣告专利权全部无效」。
此外,利伐沙班化合物专利将于 2020 年到期,国内仿制药战争已经打响。
数据显示,关于其仿制药报产受理号多达 63 个,42 个按照旧 6 类申报的受理号中,40 个已经获批临床; 按照新 4 类仿制药申报的受理号达 21 个,涉及 15 家企业,包括华海、正大天晴、石药欧意、扬子江等企业在内。
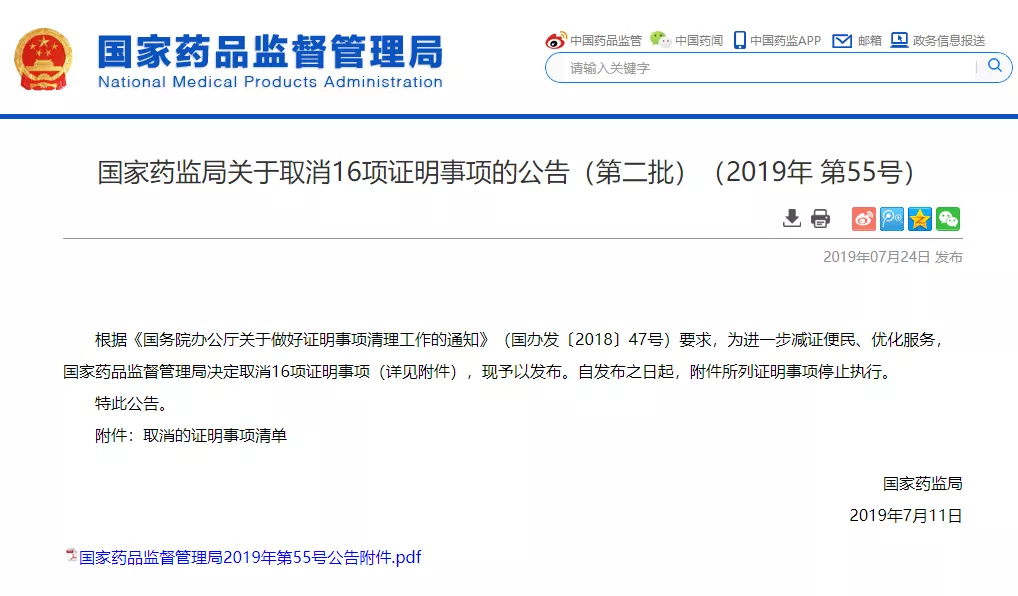
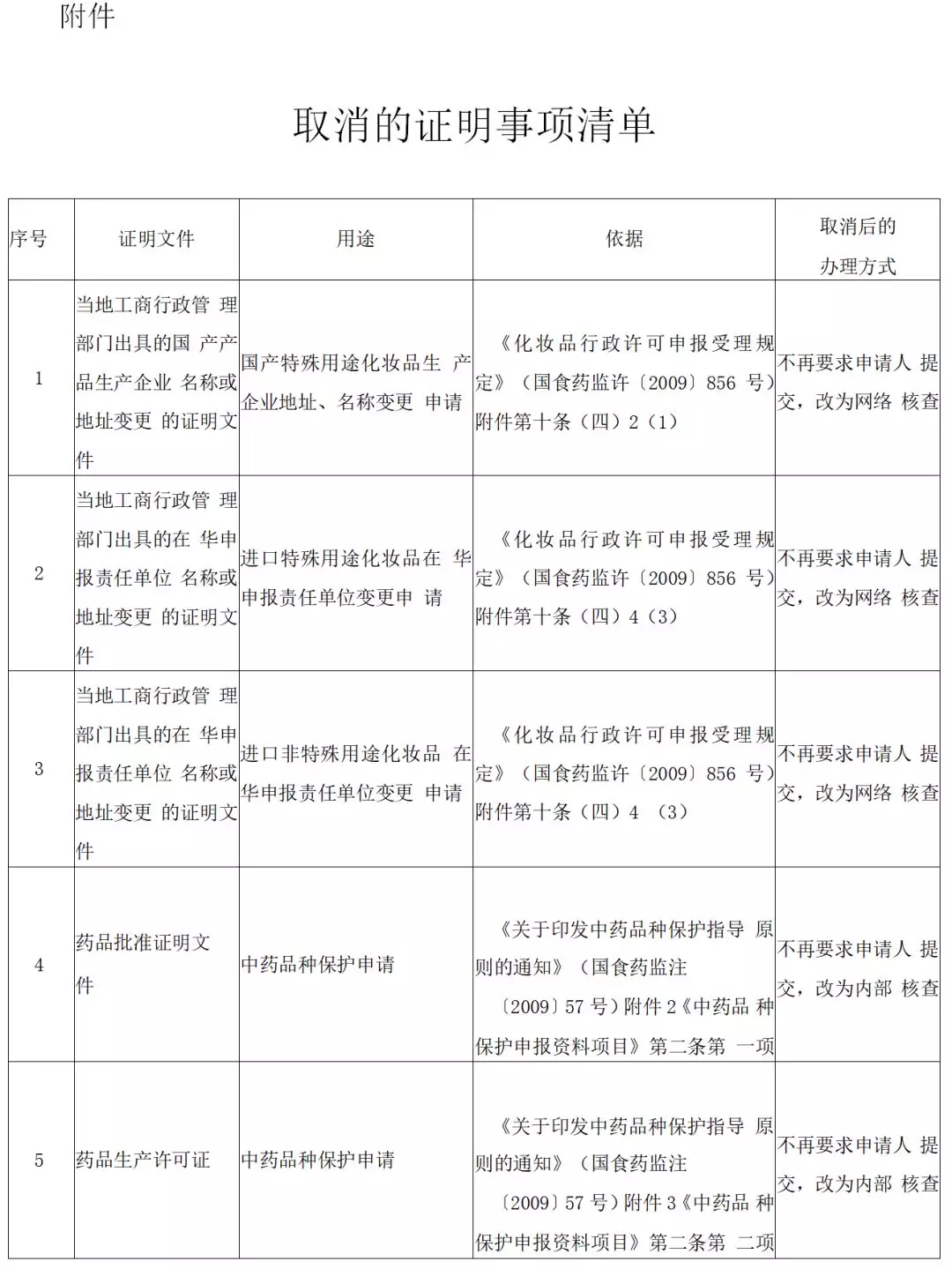
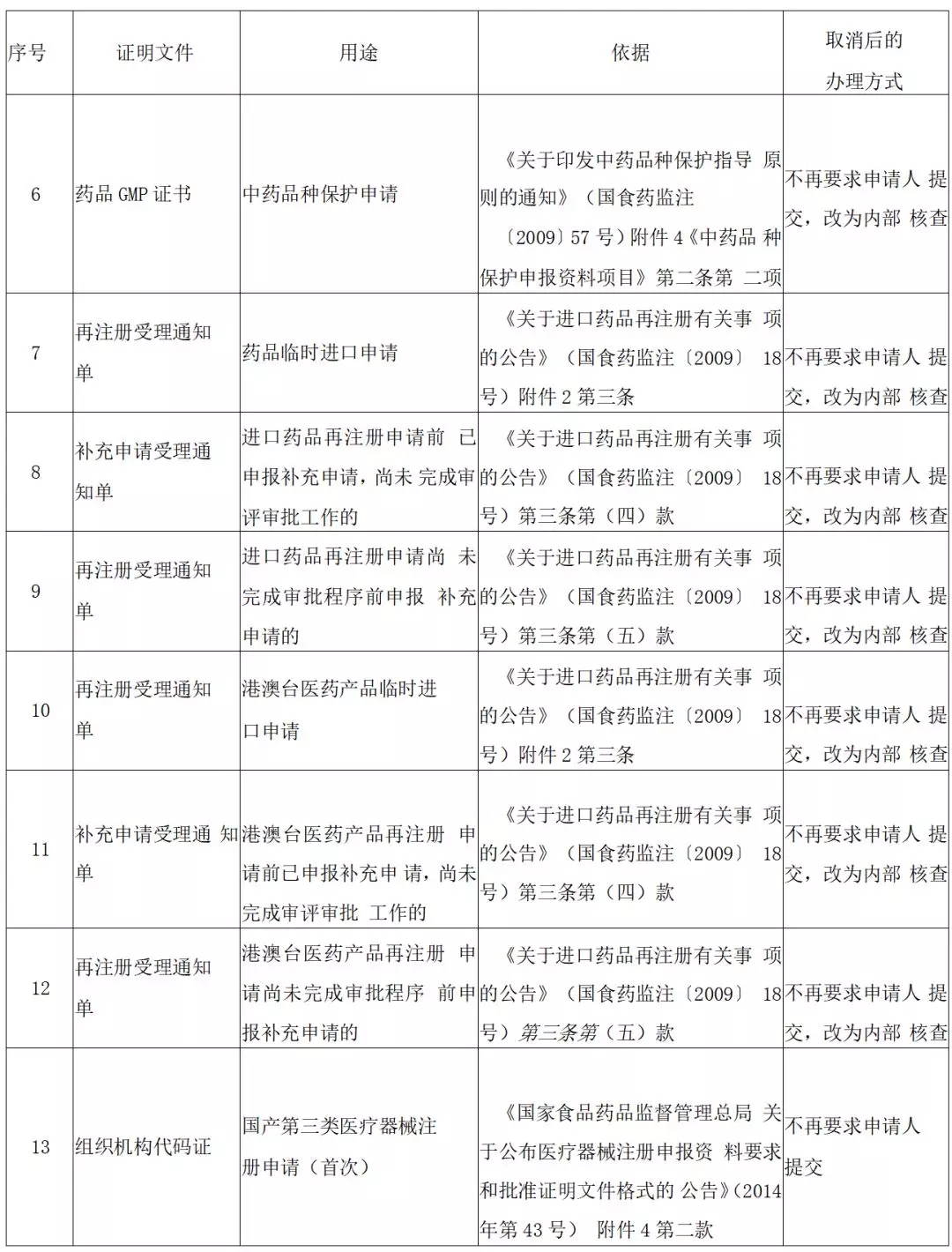
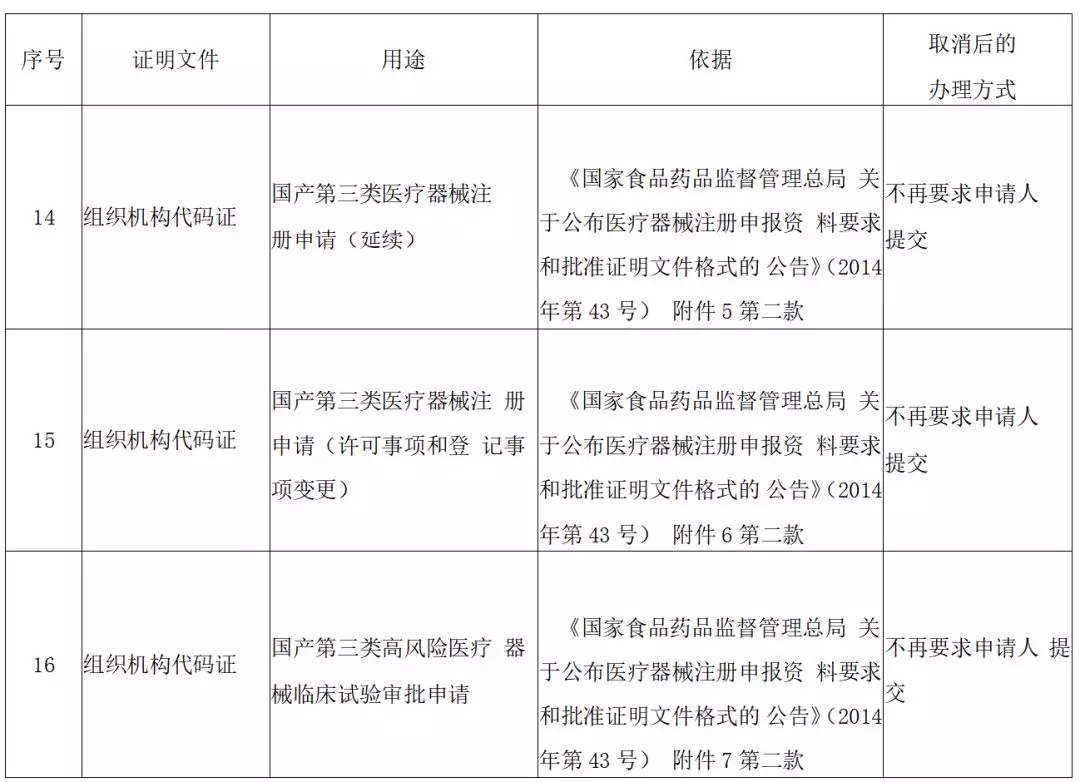
7 月 24 日,国家药监局发布关于取消 16 项证明事项的公告(第二批)。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx