6月21日,国家药品监督管理局药品审评中心(CDE)官网挂网<关于发布<国内特有品种评价建议>的通知>(简称<通知>),21个仿制药一致性评价“国内特有品种”名单及评价建议正式发布,<通知>旨在落实原CFDA<关于仿制药质量和疗效一致性评价工作有关事项的公告>(2017年第100号)的要求,进一步强调了企业承担的主体责任。

随着仿制药一致性评价工作深入推进,常态化、制度化的一致性评价工作已经推动产业进入高门槛的发展阶段,虽然“国内特有品种”的品种数量不多,但所包括的批准文号近2000个,涉及的企业数量高达数百家。业内更为关注的是,“国内特有品种”评价方法的确立,将进一步体现监管部门对于药品临床评价的监管思路和尺度,从而对产业链上下游带来影响。
围绕具体需求开展评价
事实上,早在2017年4月,CFDA发布的<仿制药质量和疗效一致性评价品种分类指导意见>(2017年第49号文),第六条规定:国内特有品种,由企业选择可重新开展临床试验证明其安全有效性。
2018年1月,CDE发布<关于进一步做好289基药目录中国内特有品种一致性评价工作有关事宜的通知>,发布了仿制药一致性评价289基药目录中的19个国内特有品种名单,要求企业落实评价国内特有品种的主体责任,根据品种具体情况及相关要求进行评估,提出科学合理的评价方案,并及时与CDE进行沟通。
更进一步,2018年7月,CDE发布<关于征求289基药目录中的国内特有品种评价建议的通知>,不仅将“国内特有品种”名单从19个增加至22个,更在名单基础上增加“评价建议”,配合新政策提出“无需开展临床有效性试验”“豁免生物等效性试验”“不建议企业对该品种开展再评价”等内容。
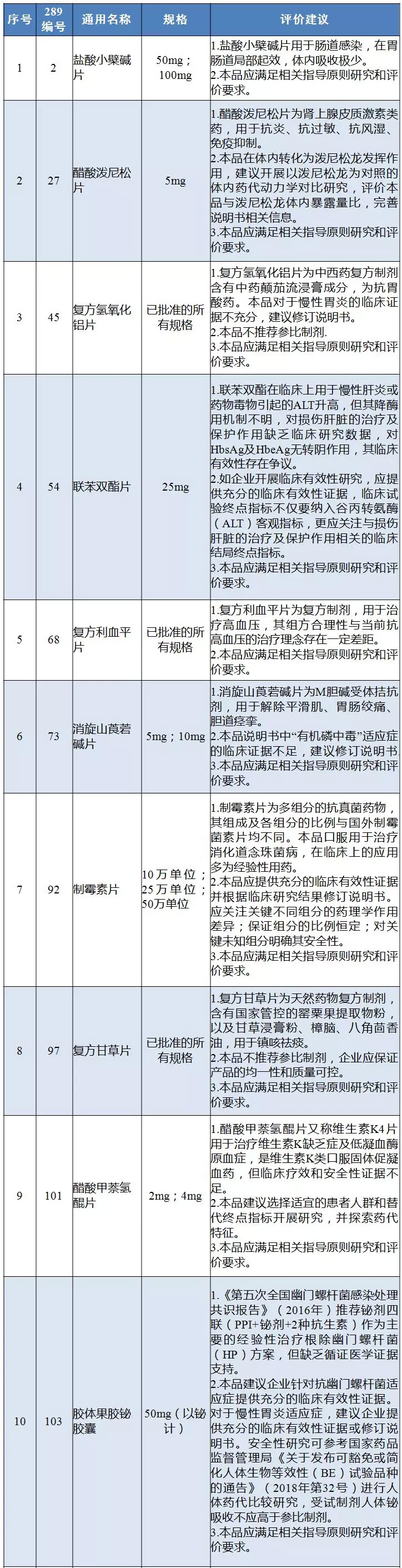
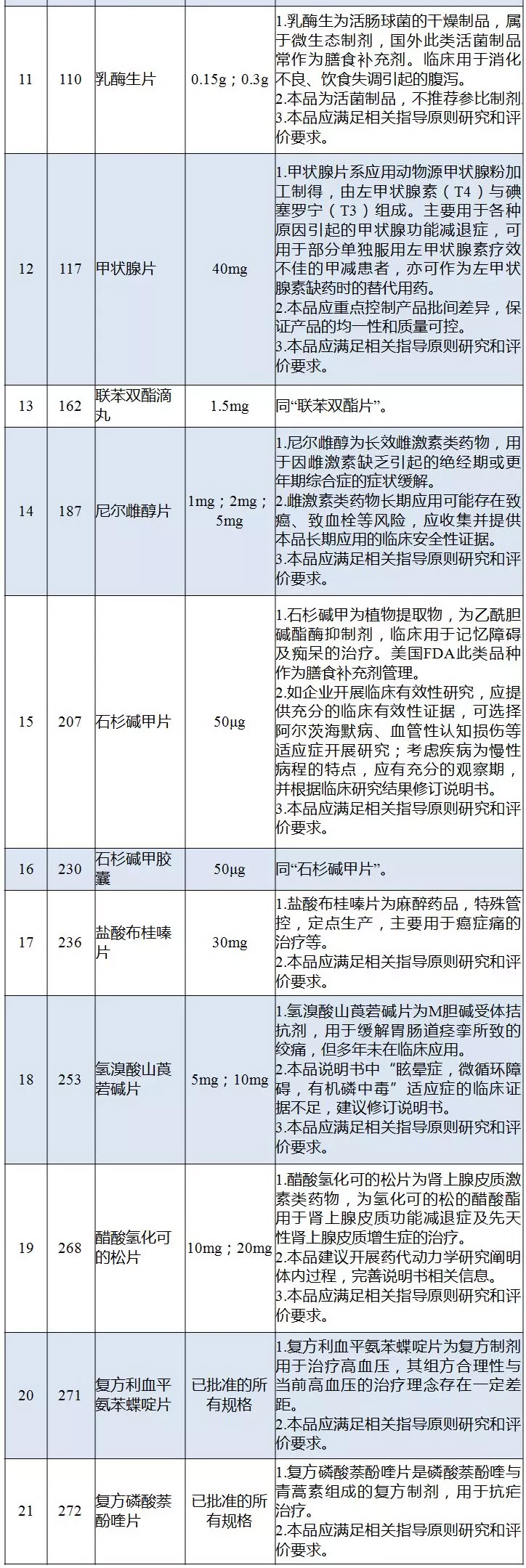
本次<通知>中所涉及的21个“国内特有品种”名单及“评价建议”,是在去年7月份二次征求意见的基础上,进一步完善和调整了名单内容,评价建议增加“本品应满足相关指导原则研究和评价要求”,对部分评价建议调整为“不推荐参比制剂”,取消了“不建议企业对该品种开展再评价”描述,并要求8个品种“完善/修订说明书”。
业内人士表示,“国内特有品种”均为上市或<药典>收载时间较早的“老药”,如盐酸小檗碱片、联苯双酯片、消旋山莨菪碱、复方利血平片等均在上世纪八十年代上市,甲状腺片、复方氢氧化铝片、复方甘草片等部分品种甚至收载于五六十年代的<药典>。
“这些品种不仅上市时间早,而且往往是价格较为便宜的产品,企业开展评价工作压力较大。”上述业内人士进一步指出,按照CDE己有的规定要求,国内特有品种的一致性评价,由企业选择可重新开展临床试验证明其安全有效性,并参照<化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)>提交申请。
市场回报机会依然存在
仿制药一致性评价一定是常态化、制度化的举措,意味着“国内特有品种”这一特殊时期的特殊产物,将可能随着产业转型升级和去产能时代到来,得到重新的定义,“二次开发”的思路或许更适合这些特殊的产品。
行业专家表示,虽然“国内特有品种”历经临床考验,但由于历史原因,这些产品的药学研究工作在工艺、处方、标准、稳定性等方面或多或少存在一些缺陷。“遵循QbD的思路,企业需要针对工艺研究、生产、质控、风控、安全性与有效性等多个维度进行产品重塑。”
按照目前的政策要求,通过仿制药一致性评价的药品将进入<国家药品目录集>,显然,依然缺乏系统规范的资料数据的品种,即使是长期应用的经典产品,想要通过评价进入<国家药品目录集>就必须补齐这部分必要的资料数据,如药理毒理、药代、药物相互作用等方面的研究。
此次发布的<通知>,也针对部分品种提出了较为具体的评价要求。以联苯双酯片为例,围绕药物在临床上用于慢性肝炎或药物毒物引起的谷丙转氨酶(ALT)升高,但临床有效性存在争议,建议企业提供充分的临床有效性证据,临床试验终点指标不仅要纳入ALT客观指标,更应关注与损伤肝脏的治疗及保护作用相关的临床结局终点指标。
如今,国家医保局牵头的“带量采购”已经展现出一致性评价和仿制药替代的政策联动效果。行业普遍认为,只要相关品种临床疗效确切,安全性有保障,质量可控品质优良,相信通过一致性评价或者企业主动申报参比制剂之后,其投入产出一定会得到相应市场的回报。
国内特有品种评价建议
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx