近年来,国内生物制品研发十分火热,根据知名商业咨询公司 Frost & Sullivan 预测,中国 2021 年生物制品市场将达 3269 亿元,无疑将成为国内药企必争之地。
生物制品具体细分包括疫苗、血液制品、抗体、重组蛋白、多肽药物、基因或细胞疗法等。 Insight 报告团队整理了近十年欧美日上市的生物制品,并按不同分类做了梳理。
2018 年日本获批生物制品
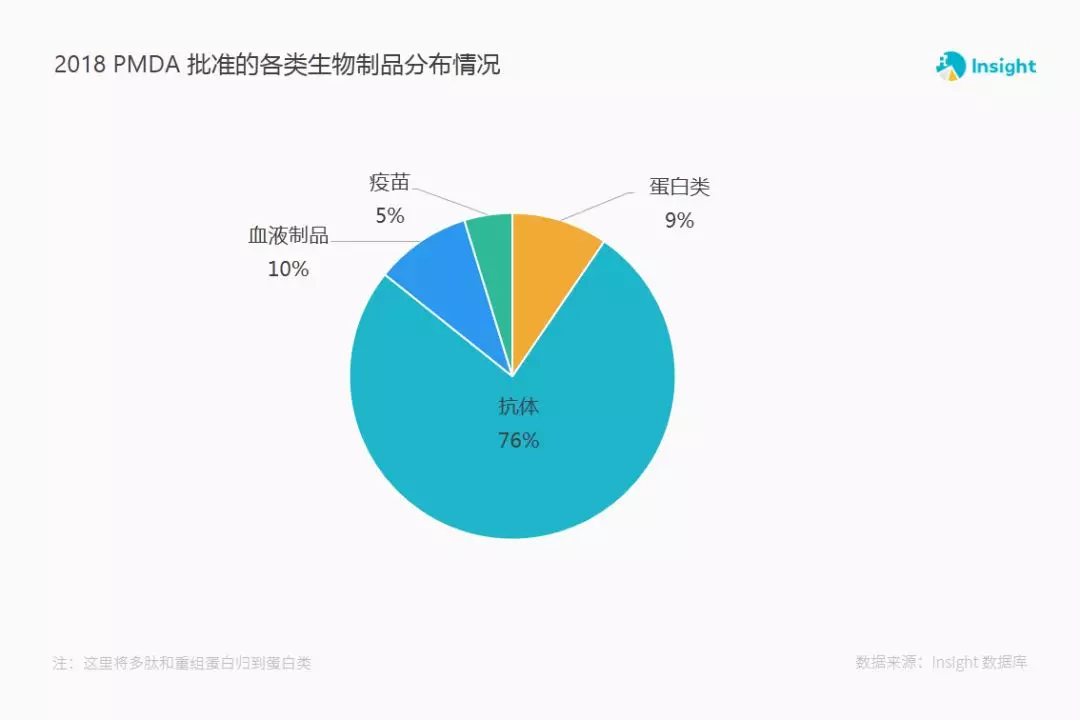
2018 年,PMDA (日本药监局)批准的生物制品有 16 个抗体,2 个血液制品,1 个疫苗,1 个重组蛋白,1 个多肽。
各分类占比情况如下图,抗体类是获批主体部分。
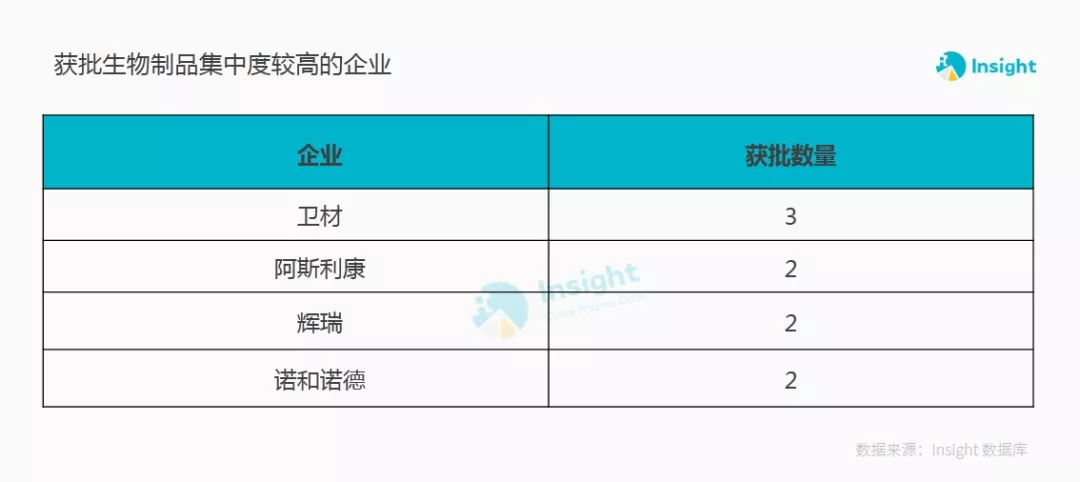
从企业维度来看,2018 年 PMDA 获批上市的生物制品所属企业中,卫材以获批 3 个生物制品位居榜首,阿斯利康、辉瑞和诺和诺德次之。
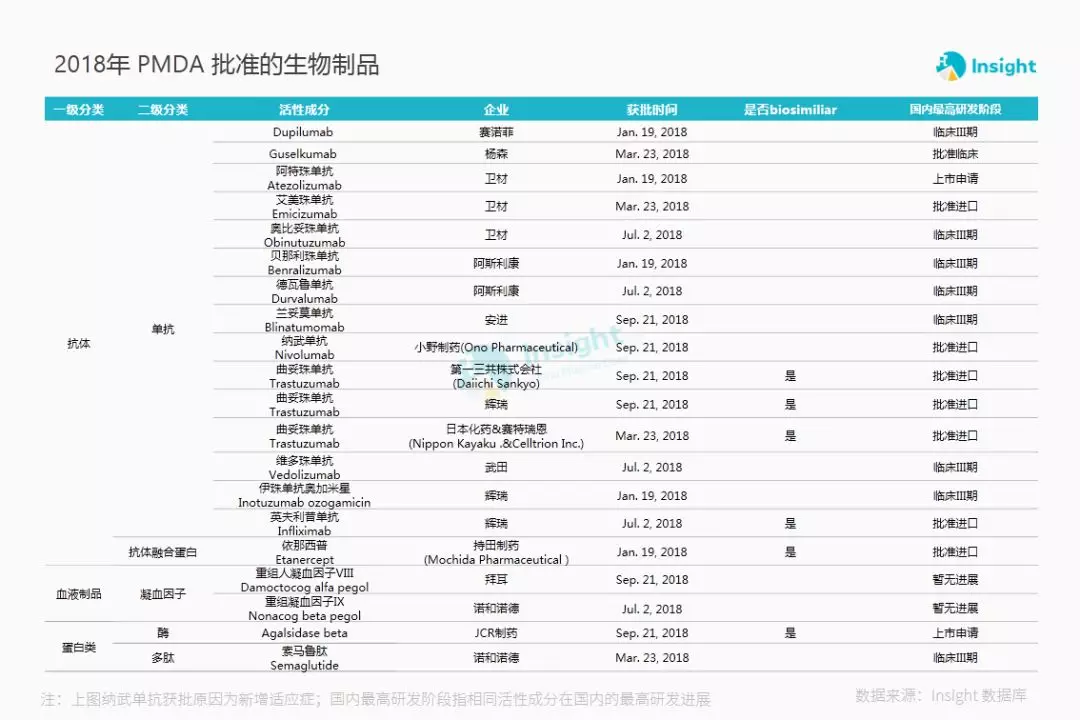
下图是 Insight 报告团队整理的 2018 年 PMDA 批准的生物制品具体品种清单
更多 FDA、EMA 数据,可在 Insight 生物制品报告查看。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx