1月28日,CDE官网发布了<化学仿制药参比制剂遴选与确定程序>(征求意见稿),意见征求时间截止2月28日。
化学仿制药参比制剂遴选与确定程序
(征求意见稿)
按照国家药品监督管理局(以下简称国家药监局)<关于仿制药质量和疗效一致性评价有关事项的公告>(2018年第102号),为全力推进一致性评价工作,优化工作程序,强化服务指导,保证公平、公正、公开,现根据相关规定,结合工作实际,明确参比制剂遴选与确定程序如下。
一、遴选原则
参比制剂遴选应以为患者提供高质量的仿制药品为目标,按如下顺序选择:
(一)原研药品选择顺序依次为:国内上市的原研药品、经审核确定的国外原研企业在中国境内生产或经技术转移生产的药品、未进口原研药品。
原研药品是指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
(二)在原研药品停止生产或因质量等原因所致原研药品不适合作为参比制剂的情况下,可选择在美国、日本或欧盟等管理规范的国家获准上市并获得参比制剂地位的国际公认的同种药品、经审核确定的国际公认药品生产企业在中国境内生产或经技术转移生产的同种药品。
(三)其他经国家药监局评估确定具有安全性、有效性和质量可控性的药品。
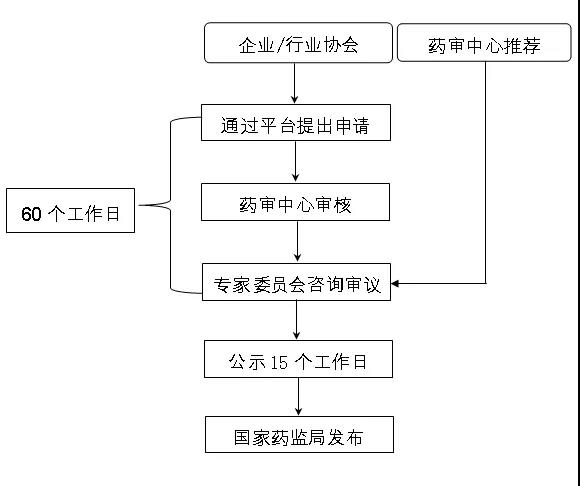
二、遴选路径
(一)企业及行业协会申请
药品生产企业或行业协会应按照上述原则,通过参比制剂遴选申请平台向国家药监局药品审评中心(以下简称药审中心)提出申请,药审中心将在60个工作日内予以答复。
企业及行业协会应按要求向药审中心提交<参比制剂遴选申请表>和<参比制剂遴选申请资料>。参比制剂遴选申请平台网址:https://wbca.cde.org.cn/wbca/。

(二)药审中心推荐
药审中心可基于药品注册资料及相关信息推荐参比制剂。
三、确定程序
(一)审核与审议
药审中心对企业及行业协会提交的申请资料进行审核,并形成初步审核意见,提交专家委员会咨询并公开审议。
(二)公示与发布
药审中心将对外公示审议结果,公示期为15个工作日,公示后,报国家药监局发布,对有异议的品种,按照参比制剂存疑处理方式处理。
(三)参比制剂存疑处理方式
企业对公示或已发布的参比制剂有异议的,可向药审中提出异议和建议,药审中心组织召开专家委员会咨询意见并公开审议,并公开审议结果。
(四)沟通交流机制
企业在参比制剂遴选与确定过程中遇到重大技术问题的,可按照<药物研发与技术审评沟通交流管理办法>的有关规定,与药审中心进行沟通交流。
四、申请资料要求
1.企业及协会应保证提交资料的真实性及完整性。如经核实存在提供虚假信息或隐瞒参比制剂存在质量问题等情况,将撤销该药品参比制剂资格。
2.主动申请作为参比制剂的药品生产企业,应保障参比制剂的质量与可及性。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx