 本文以GlaxoSmithKline1开发致突变杂质的控制策略为例探讨开发思路。限于编者的水平不当之处敬请见谅,深入了解请进一步参见原文。
本文以GlaxoSmithKline1开发致突变杂质的控制策略为例探讨开发思路。限于编者的水平不当之处敬请见谅,深入了解请进一步参见原文。
依据ICH Q8对控制策略的定义,控制策略可以分为三类控制类型:
1.属性控制:包括过程控制(IPCs)、起始物料质量标准控制、中间体质量标准控制、溶剂质量标准控制、原料药质量标准控制。
2.参数控制:涵盖对质量关键工艺参数来说在已证明的可接受范围内的操作和与关键质量属性相联系的质量工艺参数。
3.工序控制:包括设备设置、装备构造、加料顺序、试剂与溶剂选择等。
该文以某原料药为例具体说明如何开发控制策略,此原料药为氟代烷基胺的甲磺酸盐。原料药合成工艺的第一步至第三步为还原胺化,第四步至第七步为仲胺成伯胺,最后一步反应为叔胺与甲磺酸在乙酸乙酯中成盐。
由于使用到了甲磺酸,就存在形成甲磺酸甲酯(MMS)、甲磺酸乙酯(EMS)、甲磺酸异丙酯(IMS)的可能性。而MMS、EMS、IMS的形成的原因是工艺中用到了或产生了甲醇、乙醇、异丙醇。甲磺酸盐在化学药物的酸根中屡见不鲜,下面我们针对原料药的已有合成工艺进行风险评估和采用QbD的理念来开发基因毒性杂质的控制策略,希冀借助本文的研究思路使读者能管中窥豹而见全貌,以至于将本文的思路扩展到其它致突变杂质的研究。
已有人详细研究了甲磺酸酯类化合物形成的机理:1.醇类质子化;2.甲磺酸阴离子进攻质子化的醇生成甲磺酸酯和水;3.水的存在显著减少甲磺酸酯的形成;4.过量碱也能抑制甲磺酸酯的形成。
第八步成盐反应为达到较佳收率必然使甲磺酸过量因而碱不可能过量也就无法抑制甲磺酸酯的形成;同时,为保证API的物理形态和成盐的收率必须控制水的含量低于0.4%,因而无法通过增加含水量抑制甲磺酸酯类杂质的形成。
1.甲醇可来源于前一步中一个试剂的还原产物而出现在第八步的输入物料中。甲醇也有可能来源于第6步和第7步使用的试剂。还有可能来源于起始物料(取决于供应商的合成路线)。
2.乙醇来源于第八步的溶剂乙酸乙酯。也可能来源于第七步一个试剂的还原产物而出现在第八步的输入物料中。此外,乙醇还有可能在第七步工序的碱性条件下水解乙酸乙酯而生成。
3.异丙醇可能出现在第八步的反应混合物系中(还原胺化中间体中含有异丙醇)。也有可能由第八步的所使用的溶剂丙酮中引入。
4.第八步有三个相继的步骤:结晶;过滤与洗涤;干燥。
每一个步骤都存在甲磺酸酯类杂质形成的可能性,也会在各步工序中清除。下面,我们按照结晶、过滤与洗涤、干燥三个工序分别进行论述。
通过风险评估可以识别导致甲磺酸酯类杂质形成和累积的工艺参数分为两大类:影响形成基因毒性杂质动力学的参数和影响结晶从而会影响基因毒性杂质形成和累积的参数。对于前者采用增强的条件考察其如何影响基因毒性杂质的形成(见表1);对于后者通过结晶参数范围的变化考察其如何影响致突变杂质的形成与累积(表2)。
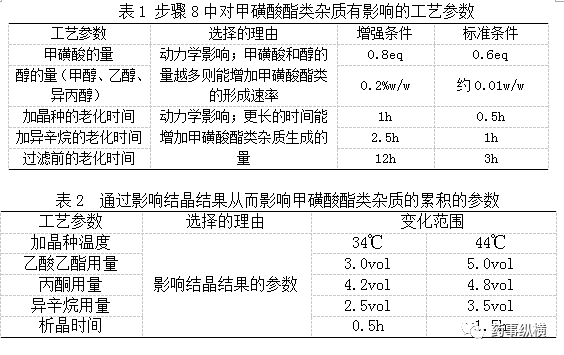
对于表1中的所选甲磺酸的量是为了使形成基因毒性杂质最大化。本表中的实验采用单因素实验予以研究。对于表2中的参数采用DoE实验设计(5因素2水平部分因子设计)对本表中各因素进行研究。
每个实验对过滤前的悬浮体和甲磺酸胺盐都进行了测定。所有实验对过滤前的悬浮体测试的结果表明MMS、EMS、IMS含量低于1ppm;滤饼甲磺酸胺盐中MMS、EMS、IMS的含量远低于1ppm。
研究结果成功地证实了在拟定的参数范围内不会产生MMS、EMS、IMS。因此,既没有一般工艺参数也没有关键工艺参数与第八步骤结晶工序中MMS、EMS、IMS的控制相关联。
通过过滤去除母液后,原料药滤饼用12倍体积的乙酸乙酯洗涤。为了理解和评估过滤和洗涤工序MMS、EMS、IMS形成的可能性进行了两种不同的研究工作。
首先进行的是在动力学增强条件下基因毒性杂质形成的可能性研究。氟代烷基胺在标准条件(表1和表2中工艺参数的目标值)下结晶后弃去母液,湿滤饼悬浮于4份体积的乙酸乙酯中。增强条件是乙酸乙酯中含有0.2%w/w(典型工艺中少于0.01%w/w)的醇类(甲醇、乙醇、异丙醇)和确保足够量的甲磺酸(中间体3的0.1当量)以是基因毒性杂质的生成量最大化。所得悬浮体控温于30℃搅拌2小时以模拟动力学标准条件下的首次洗涤。悬浮体过滤,弃去母液,滤饼不再洗涤直接干燥。对悬浮体和干燥后的滤饼进行检测,结果表明MMS、EMS、IMS均低于1ppm。这表明甚至在动力学增强条件下洗涤工序不产生甲磺酸酯类基因毒性杂质。
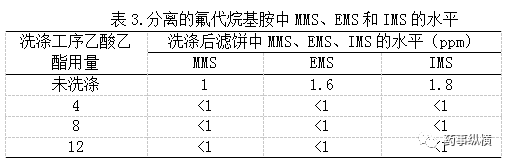
接着研究了向工艺步骤中对基因毒性杂质加标,考察在第八步过滤工序中提高甲磺酸酯了杂质的水平的情形下而工艺对MMS、EMS、IMS的清除能力。氟代烷基胺甲磺酸盐以目标条件结晶,所使用的甲磺酸含有2500ppm的MMS和2600ppm的EMS(等同于甲磺酸质量标准中MMS和EMS限度的5倍)以及1200ppm的IMS。恰在过滤前再次引入1600ppm的MMS、2200ppm的EMS、2900ppm的IMS。过滤结束,使用不同的洗涤方法对滤饼进行洗涤,这些方案是:未洗涤、4体积乙酸乙酯洗涤、8体积乙酸乙酯洗涤、12体积乙酸乙酯洗涤。滤饼抽干溶剂并控温于40℃减压干燥(无搅拌)。所得固体进行测试,结果如表3所示。
表3的分析结果证实了完全干燥后的原料药中MMS、EMS和IMS的水平接近于方法的定量限,甚至在未进行洗涤的情况下也是如此。洗涤工序进一步减少了API中残留MMS、EMS和IMS的风险,从而获得宽裕的安全范围。
本文也对氟代烷基胺的干燥工序MMS、EMS和IMS生成的可能性进行了研究。具体实验是:将第八步骤的结晶和过滤工序按照工艺条件的目标值进行,所得氟代烷基胺的湿饼悬浮于含有0.2%w/w甲醇、乙醇和异丙醇的1体积的乙酸乙酯(实际发现值最高水平不高于0.01%)中,控温于60℃在大气压下打浆13小时。此增强条件比标准条件(减压干燥且温度为40℃)要剧烈。实验结束滤除溶剂,固体干燥。
研究中分别对过滤前的悬浮体和干燥后的固体进行了MMS、EMS和IMS含量检测。检测结果表明无论是悬浮体中还是干燥后的固体中MMS、EMS和IMS含量低于1ppm。这表明干燥工序不会产生甲磺酸酯类基因毒性杂质,纵使在增强条件下也是如此。
总之,对第八步工艺进行的研究支持以下结论:
~成盐和结晶工序中过量甲醇、乙醇和异丙醇的存在(甚至各自增大至0.2%)不会导致MMS、EMS和IMS的形成。
~过滤和洗涤工序甲醇、乙醇和异丙醇的存在不会导致MMS、EMS和IMS的形成。
~过滤工序可以有效去除MMS、EMS和IMS。
~干燥工序不会产生MMS、EMS和IMS,甚至是提高甲醇、乙醇和异丙醇的水平以及干燥温度提高至60℃也是如此。由于没有更高干燥温度的数据因此设定60℃为干燥温度的上限。
到目前为止生产的所有批次的原料药按照API(MMS、EMS、IMS)的CQAs进行检测其致突变杂质的含量均不过分析方法的定量限(1ppm)。基于以上研究结果和检测结果可以作出如下科学合理的结论:撤去原料药终产物中基因毒性杂质的检测而转化为对生产工艺中上游属性进行控制从而控制杂质,其控制策略为:四种物料属性控制、一个参数控制、一个工序控制。具体如下:
~物料属性控制之一:控制甲磺酸中MMS和EMS含量不过500ppm。
~物料属性控制之二:控制乙酸乙酯中乙醇含量不过0.1%(w/w)。
~物料属性控制之三:控制丙酮中异丙醇不过0.05%(w/w)。
~物料属性控制之四:控制第七步重结晶终产物中甲醇、乙醇、异丙醇各自限度不过0.1%(w/w)。
~参数控制:控制干燥温度不过60℃。
~工序控制:过滤后洗涤滤饼。
结论:按照ICH和其它指导原则所要求的QbD基本理念提供结构化的方法以获取工艺知识及开发耐用性的工艺控制策略。这一理念成功的应用于开发氟代烷基胺甲磺酸盐的控制策略、原料药的生产工艺、特别是潜在基因毒性杂质的控制等。
注:本文是控制策略开发的典范,值得深入学习。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx