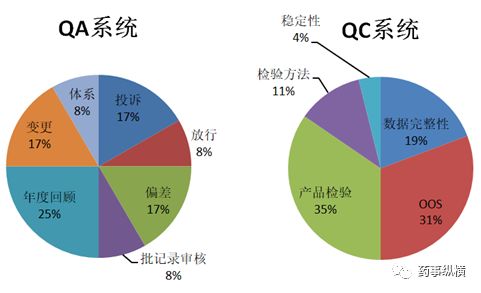

数据完整性缺陷在2017年3季度有下降趋,三年多的重灾区,各企业都给予了足够的重视,而在工艺规程和验证、OOS和稳定性方案等方面成上升趋势。
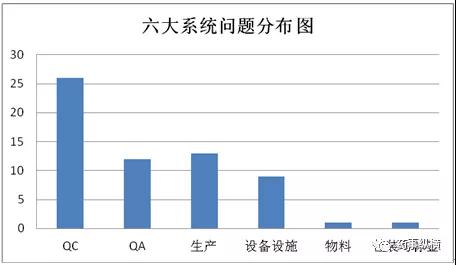
QC因数据完整性FDA警告信的数量偏多;QA 的主要问题分布比较平均,在质量保证各方面都做好不是一件容易的事情,需要很强的质量保证能力;生产系统主要问题集中在批生产记录和工艺验证方面,现在越来越强调工艺验证的方法,工艺验证的三个阶段都很重要,这个思路一定要转变过来,要么以后工艺验证检查还会出现相同的问题,批记录也跟工艺验证相关,也跟前期的工艺研究相关,前面基础打不好后面批记录的执行上面就会出现问题;设备方面无非就是设备清洁、设计与维护保养,现场认认真真去做不会有太大的问题。
检察官会针对现场的薄弱点进行针对性的检查,而且这些检查点会延伸引发系统性问题,比如:
(1)稳定性引发数据完整性问题,引发偏差调查问题;
(2)客户投诉引发CAPA执行不到位,重复出现问题;
(3)OOS引发的数据完整性,原因调查不到的CA;
(4)微生物检测引发水系统微生物控制问题,例如:引发水系统微生物控制问题。
从现场水系统报告的值与实际检测结果不一致,微生物培养基上实际检测到了,但在记录上没有体系,从而引申至水系统的微生物控制不到位的问题,并要求提进行CAPA:
(1)一份你们的水系统设计、控制和维护独立的评估;
(2)一份改进你们水系统的设计、控制和维护的全面纠正预防措施(CAPA)计划;
(3)XX水系统的验证报告;
(4)一份对你们水系统设计所做的改进总结,以及你们持续控制和维护的计划当前用于此系统的总计数和内毒素限度。
数据完整性
引发条件:OOS调查,HPLC检查,稳定性数据和反复进样。
主要缺陷:
(1)权限管理不到位
(2)审计追踪没开或审计追踪没能覆盖到位
(3)数据备份及备份恢复不可以使用,分析数据备份缺失
解决方案:
按照最近集中推出的数据完整性法规认真执行,提升工艺执行水平,稳定性按计划执行,出现OOS结果认真对待,找出根本原因。最好能请第三个机构对公司的数据完整性及至体系进行审计,以更有效的解决此问题。
OOS
引发条件:OOS原因没有调查清楚就舍弃原结果;稳定性检测结果;检测结果
不正常就被舍弃;没有进行第二阶段调查就进行复测。
主要缺陷:
(1)OOS程序不完善,缺乏第I阶段化验室调查来支持你们宣布原始结果无效;OOS根查原因分析不到位,不能准确查找原因
(2)缺乏第II阶段调查来评估你们的生产操作以发现可能的根本原因。
(3)无效OOS数量太多
(4)OOS调查不充分,不能反映出系统的问题
解决方案:
完整地、诚实地调查OOS结果,采用科学的原则评估,确定根本原因,吸取以往的经验,制定解决问题的永久措施
工艺验证
引发条件:生产时出现大量OOS,工艺偏差,年度质量回顾,验证状态的维持。
主要缺陷:
(1)工艺设计与研究阶段不到位,造成生产时出现大量OOS;
(2)工艺确认阶段研究不到位,现场偏差未能充分分析,查找根本原因,有效的解决工艺缺陷。
(3)没识别出你们批记录中所有显示关键操作步骤和关键工艺参数
(4)未实施工艺确认研究和,缺乏持续的工艺控制监测计划以确保适当的生产操作和一致的药品质量
解决方案:
自从FDA发布了2011年修订后的工艺验证指南已有5年了,FDA给企业充足的时间实施新指南了,所以对工艺验证要求要按新法规执行了,工艺验证认真的按三个阶段进行工艺验证,现在强调持续的工艺验证,工艺验证要求越来越严格,工艺验证要充分详尽,运用风险评估的方法确定关键工艺参数,制定详尽的验证主计划和持续工艺控制监测计划,估好年度质量回顾(最好做好质量月报,做好各产品各工序质量数据及关键参数汇总分析)以确保稳定的生产操作和持续的药品质量,出现偏差及时进行调查、风险评估及进行再验证。确保生产工艺或工艺环境的计划性或意外变更不会对生产工艺和产品质量产生不良影响,做好变更控制。
另其中关键工艺参数的确定可以:
(1)可以通过实验设计(DOE)研究来帮助开发工艺知识,包括可变输入与结果输出之间多种因素的相互作用来进行。
(2)风险分析工具可用于筛选研究中的潜在变量,实现最小化实验来获得最大化的知识。DOE研究结果可以作为建立以后成品质量、设备参数以及中间体质量标准的依据。
(3)工艺过程分析技术(PAT)的应用,实现设计、分析、和控制生产过程以及急时地测量(在工艺过程中)。
设备设施预防污染
如果工厂有高致敏性物质,如青霉素或头孢菌素类的生产,要注意了,应当使用专用的生产区,包括设施、空气处理设备和/或工艺设备,并做相应的风险与控制措施。
引发条件:生产现场投料,物料的贮存,包装过程,设备设施维护状态不到位。
主要缺陷:
(1)使用开放设备时未使用适当的预防措施以降低API污染风险。
(2)未能对设备进行妥善维护,并保存主要设备维护的完整记录。
(3)未能在适当条件下包装XX药品(包括XX和YY)和其它药品以避免潜在交叉污染。
解决方案:
现场防护做到位,预防外来污染;虫害控制措施有效;要加强设备附属物的管理,更换清洁记录,如滤包的更换,滤袋更换,滤芯的更换,要有频率和标准。
设备清洁
引发条件:现场卫生清洁不到位,让人检查员看到存在污染的可能性了;现场已已清洁设备里面有残留的物料痕迹;清洁后的设备里面有螺丝、管头等;滤包、过滤器的清洁等。
主要缺陷:
(1)设备未进行适当设计,适合其既定用途和API生产清洁。
(2)未能适当维护用于中间体和原料药生产的厂房和设备。
解决方案:
不能因为是专用生产线,就降低这块的重视程度,现场一定要清洁到位;清洁SOP的适用性与执行情况包括:清洁的原则、范围、频次等,清洗的程序、次数,检查与接受标准,清洁后的存放,必要时查看清洗记录及设备使用日志。
CAPA纠正和预防系统
引发条件:药品生产的各个环节都可以引发CAPA,目前483回复时各种整改根本原因分析不到位,措施的有效性差,没有从整体系统解决问题,只关注某一部分解决问题。
主要问题:
(1)缺乏对你们偏差调查、异常事件、投诉、OOS结果和失败全面系统的综合评估和补救措施。
(2)未能充分调查OOS结果,并实施适当的纠正措施。
(3)工艺确认阶段研究不到位,现场经验未能充分分析,查找原因,有效的解决工艺缺陷。
(4)OOS调查未确定根本原因,也就是缺乏科学论断来判定初始OOS结果无效。
(5)检验方法的专属性存在问题,应延伸到化验室其它检验方法的专属性
解决方案:制定一个好的程序
可以参照下各步骤认真的执行:
第一步:CAPA的启动 来源---数据分析与统计
第二步:CAPA的调查 问题描述---根本原因调查---风险评估---提出方案
第三步:CAPA行动方案的制定 可行性与科学性
第四步:CAPA的执行 执行---跟踪---日常管理
第五步:CAPA的关闭 完成的证据(前后)
第六步:CAPA有效性的确认 相同/类似的问题有没有重复发生
第七步:CAPA沟通
系统化专业的方法 重点和难点是潜在原因的调查 ,我们可以通过以下工具和方法调查根本原因,找到问题的关键,以制定有效的措施,预防和杜绝问题再次发生。
?画一个过程流程图并识别所有变量(流程图法)
?问题和过程之间是否可以建立联系(鱼骨图法)
?若干个为什么(5个WHY法)
?什么地方改变了(故障树法)
?为什么以前没见过
?访问操作者和相关人员
提供相应的资源
?经培训人员
?历史数据
?知识积累与留存
?专题专家
以上各方面做好以后,CAPA自然而然的就做好了。
领导作用:企业的高层重视GMP,重视质量管理,这个企业的GMP执行起来才会接地气,执行到位,让GMP真正对企业的发展起到推动作用。
聘请顾问:FDA强烈建议企业邀请第三方机构进行审计、检查及解决问题,FDA不太相信企业自身能够合规地完成这些要求,FDA会对整个企业所有的计算机体系和产品进行全面评估,以便确定产品的风险程度。
培训做实:
这里边有几点经验分享一下,
(1)熟练员工操作拍成视频,还有模块化的东西可以做成网络培训课程,存档做好编号,让员工按类别学习。
(2)培训进级制:新员工、初级员工、中级员工、高级员工
(3)培训卡片,宣讲,自已学习,定期考试
(4)培训证书的管理和绩效挂钩
(5)新员工培训
执行到位:平时认真执行,逐步提升,逐项改进,改进一项就做实一项,解决问题时多想几个为什么,分析问题到本质,提出有效的解决方案。
以上是针对近期FDA检查警告信的一点浅薄的分析,希望能对大家工作能有一点帮助。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx