
根据总局<关于鼓励药品创新实行优先审评审批的意见>(食药监药化管〔2017〕126号),我中心组织专家对申请优先审评的药品注册申请进行了审核论证,现将拟优先审评的药品注册申请及其申请人予以公示,公示期5日。公示期间如有异议,请在我中心网站“信息公开-->优先审评公示-->拟优先审评品种公示”栏目下提出异议。
第三十一批拟纳入优先审评程序药品注册申请公示名单如下:
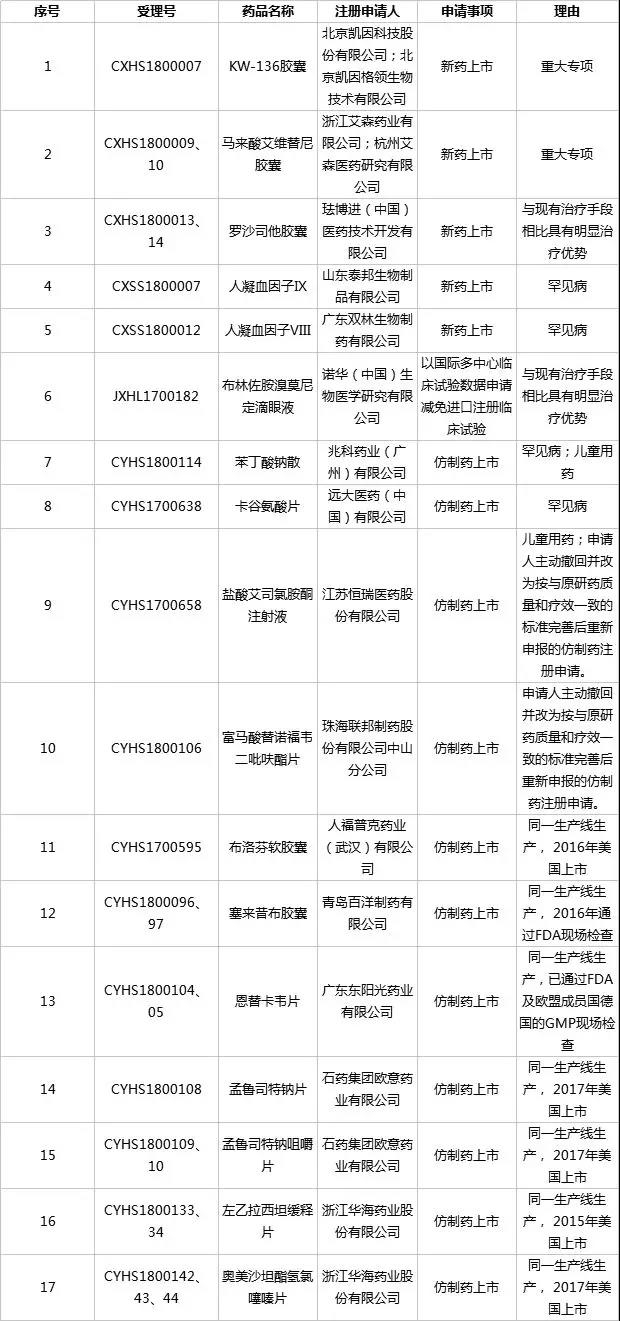
以上内容为国家药监局药审中心发布新一批优先审评名单(第三十一批),17个受理号拟纳入优先审评程序,其中,有6个新药上市申请,而上市公司纳入的都是仿制药,共有6家上市公司8个仿制药入选。
远大医药的卡谷氨酸片以罕见病为由入选,恒瑞医药的盐酸艾司氯胺酮注射液以儿童用药等理由入选,联邦制药的富马酸替诺福韦二吡呋酯片以“申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申报”入选,东阳光药的恩替卡韦片以“同一生产线生产、已通过FDA及欧盟成员国德国的GMP现场检查”入选,石药集团的孟鲁司特钠片和孟鲁司特钠咀嚼片以与东阳光药类似的理由入选,华海药业的左乙拉西坦缓释片和奥美沙坦酯氢氯噻嗪片入选理由也类似于东阳光药。
在这些申请中,富马酸替诺福韦二吡呋酯片和恩替卡韦片均为乙肝用药,此前,已有、广生堂、中国生物制药等获批上市及通过一致性评价;孟鲁司特钠为重磅儿童药。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx