本书邀请国内外生物制药领域权威、一线药物研发专家(包括1名William Coley奖获得者、1名院士、11名“千人计划”专家、1名前美国FDA新药审评员、数十名制药企业首席执行官、研发总监及高校教授),对大量文献、专利以及研发数据信息进行了整理和分析后,汇编而成。
<世界新药概览单克隆抗体卷I>分别从靶点生物学,抗体药物基本信息(包括氨基酸序列、作用机制图、批准的适应症及用量、上市后的每年销售额等),临床前药理、药代、毒理试验数据,临床疗效与安全性试验数据,以及关键专利信息几个方面进行了详实、精确的数据汇整;同时也给出了相关专利、文献和资料以及数据的来源。这些数据和相关信息线索,可大为节省科研工作者文件检索和有效信息的筛选时间,特别是为从事biosimilar、biobetter及创新性抗体药物的研发人员提供有价值的参考。
以Ado-trastuzumab emtansine和Trastuzumab(曲妥珠单抗)为例,详细介绍本书的价值与意义。
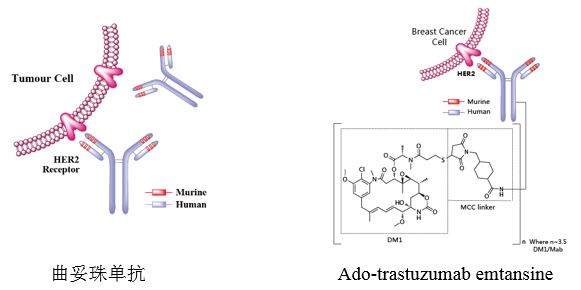
Ado-trastuzumabemtansine和曲妥珠单抗的作用靶标均为HER2受体,Trastuzumab于1998年获FDA首批,是一种人源化IgG1κ型单克隆抗体,其与肿瘤细胞上的HER2结合并介导抗体依赖的细胞毒作用,用于治疗HER2过表达的乳腺癌、HER2过表达的转移性胃癌或食管胃交界腺癌患者。Ado-trastuzumabemtansine于2013年获FDA首批,是曲妥珠单抗和微管抑制剂的偶联物,通过抑制HER2信号通路并破坏微管网络诱导细胞周期停止和凋亡,用于治疗HER2阳性且既往至少接受曲妥珠单抗、taxane单独或联合治疗的转移性乳腺癌患者;二者2016年和2017年的全球销量分别为68.5亿美元和8.4亿美元,71.6亿美元和9.3亿美元。
临床前体内试验显示(细胞系包括MCF7、BT-474、CaOV3-HER2、NCI-N87和NCI-N87),曲妥珠单抗单药治疗或联合其他药物(Doxorubicin、Paclitaxel、Cyclophosphamide、Methotrexate、Etoposide或Vinblastine)治疗均可显著抑制肿瘤的生长;动物试验中未发现特别严重的毒性作用;其治疗转移性乳腺癌、早期乳腺癌以及转移性胃癌的临床有效性和安全性主要分别基于一个关键的三期试验HO648g和两个关键的支持性试验HO649g(三期)和M77001(二期),三个三期试验BO16348、NSABPB-31和NCCTGN9831,以及一个三期试验ToGA(BO18255);并通过无进展生存期、总缓解率、临床获益率、疾病进展时间、总生存期等关键参数对其有效性进行评估,相关P-值均小于0.1。几种适应症中最常见的不良事件包括发烧、恶心、呕吐、腹泻、感染、咳嗽、头痛、饥饿、呼吸困难、皮疹、中性粒细胞减少、乏力、肌痛、血小板减少、鼻咽炎和味觉障碍等。
Ado-trastuzumabemtansine是在曲妥珠单抗的结构上增加了SMCC (DM1和MCC两个片段),详见图1。临床前活性研究发现,以曲妥珠单抗-MCC-DM1的EC50为100%,曲妥珠单抗、DM1和MCC-DM1相比曲妥珠单抗-MCC-DM1的EC50分别为28.2%、4.8%和1.1%。临床前毒理研究中未发现特殊的毒性作用。Ado-trastuzumabemtansine的临床有效性和安全性数据基于4个关键性试验:TDM4258g(二期)、TDM4374g(二期)、TDM4450g(二期)和TDM4370g(三期)。基于对客观缓解率、无进展生存期、总生存期和持续有效时间等关键参数的评估,在无进展生存期以及总生存期两方面的临床获益最突出。主要的临床不良事件包括腹泻、掌跖红肿、呕吐、中性粒细胞减少、低钾血症、饥饿、乏力等。
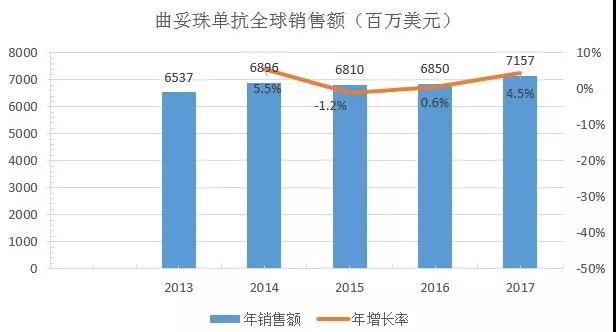
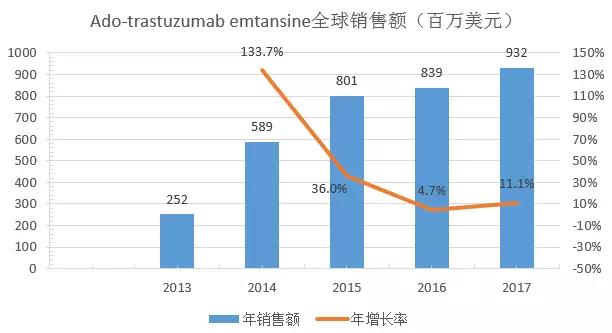
通过两个药物临床前、临床关键核心数据的对比,可迅速获得相关药效差异、安全性差异,并为单克隆抗体药物的研发提供一种思路。虽然目前曲妥珠单抗的全球销售额远超Ado-trastuzumabemtansine,但Ado-trastuzumabemtansine的增长率远超曲妥珠单抗,可以预测,Ado-trastuzumabemtansine因其临床有效性、安全性以及良好的市场拓展配合,其未来市场份额将逐渐提高。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx