题记
随着“通用技术文件CTD”在药品研发-注册方面的普及,以及当今电子化办公的发展,eCTD已经越来越受到全球药品行业的重视,替代纸板CTD,似乎指日可待。然而,正如曾经CTD发展的不易,eCTD虽看似是今后之必然,但若想快速取代今天的CTD,绝非易事。不过,毕竟符合历史发展的事物,终究会发生一定的替代,故了解关注eCTD的发展过程与政策,对于药物研发人员来说,还是很有必要的。PS:在上篇<浅谈:药品通用技术文件CTD的那些事(一)>中主要介绍了国际环境下及我国CTD的发展过程,本篇即在(一)的基础上,继续对CTD相关内容之eCTD进行简要概括。
国际环境下的eCTD~简介
eCTD (electronic CTD),简言之就是纸板CTD注册文件的信息电子化产物,它在信息可视化、文件链接化和传递快捷化上均有别于纸板CTD文件注册,加快了申请人和审评人之间的信息沟通速度,可以保证注册文件模块完整化提交和注册资料的最新版本等。
eCTD,最早依旧源于ICH,该组织的M2专家工作组(EWG),于2003年10月制定并发布了关于药品电子提交的通用标准,并被美国FDA、欧洲EMA、日本MHLW以及加拿大等国广泛推行。其规定了申请人向药政当局提交电子文件的目录结构及文档格式,并采用XML语言的文件类型对整个递交及各申报文件的元数据进行管理,以组成综合的目录并提供相应的引索。同时简化了申报文件的创建、审核、生命周期的管理以及文件的储存。
美国FDA对eCTD的要求
2015年5月5日,FDA发布了第三版以电子格式提交药政文件的行业指南。在当时,该指南规定至发布日的24个月后,所有的新药申请(NDA),简化新药申请(ANDA),生物证书申请(BLA)和原料药主文档(MF)都必须以eCTD格式进行提交。而用于商业行为临床实验新药申请(IND)的电子提交要求在36个月后生效。根据联邦法令745A(a)的规定,非商业化IND提交不在上述要求范围内,但FDA也接受其电子化申请。2017年4月,FDA发布了最新的eCTD指南,确定将MF强制执行电子提交的时间推迟到2018年的5月5日,且任何不符合eCTD行业指南中要求的提交都将被FDA拒之门外。如上所述,对于所有此类申报类型,FDA要求必须采用电子方式提交,包括增补、变更及年度报告。
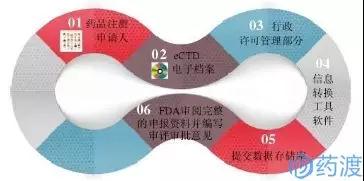
图1 美国FDA~eCTD流程图
我国对eCTD的态度
eCTD,作为ICH-CTD发展道路上的一个里程碑,是符合注册申报发展趋势的产物,也是我国CTD格式申报今后需要发展电子提交平台的方向和需要达到的长远目标。目前国际化注册的主流形式化逐渐转变为eCTD格式申报,虽然我国在纸扳CTD格式的道路上渐行渐稳,但若要与国际化注册全面接轨,就不得不考虑引入eCTD申报。
CFDA发布的<2015年全国药品注册管理工作会议精神>中,也指出要“制定统一的注册申请规范,扩大CTD格式在药品注册申报中的作用,逐步实现药品注册申请的电子递交”。
而在刚刚过去的2017年,药审中心就关于eCTD相关内容进行了大量的工作,如2月份在京召开eCTD项目讨论会;4月份召开eCTD软件开发企业座谈会;8月份举办eCTD专题培训研讨会,等等。
eCTD格式申报标记语言
2003年,ICH Multi-disciplinary Group 2(M2)在CTD的基础上制定了eCTD的标准。规定了药品生产企业及研发机构向药品审评机构进行电子提交的标准目录结构和文档的格式要求,也对目录和文件的命名规范进行了限定,并采用可扩展标记语言(XML)对元数据核文档结构进行描述,同时也对电子提交资料的创建、查询、生命周期管理、归纳档案等方面进行了规范。
XML是一种简单灵活的文本格式的可扩展标记语言,起源于SGML,XML提供了一种标准化、灵活、强大的方法,用于在许多不同平台(Windows/Mac OS/Linux)和应用程序之间交换数据,XML使用Unicode字符集,几乎支持所有语言,因此,自1998年诞生以来,XML已经成为Web信息传递的首选方式。
由于eCTD申报材料的准备涉及XML Backbone的创建DTD和Stylesheet文件的管理、文件生命周期(Lifecycle)的管理以及模块5加密,故目前国际知名制药公司(如Pfizer, Merck, AZ)都是购买专业的软件来进行eCTD申报,而主流软件有CSC公司的eCTDXPress和PAREXEL公司的LIQUENT。
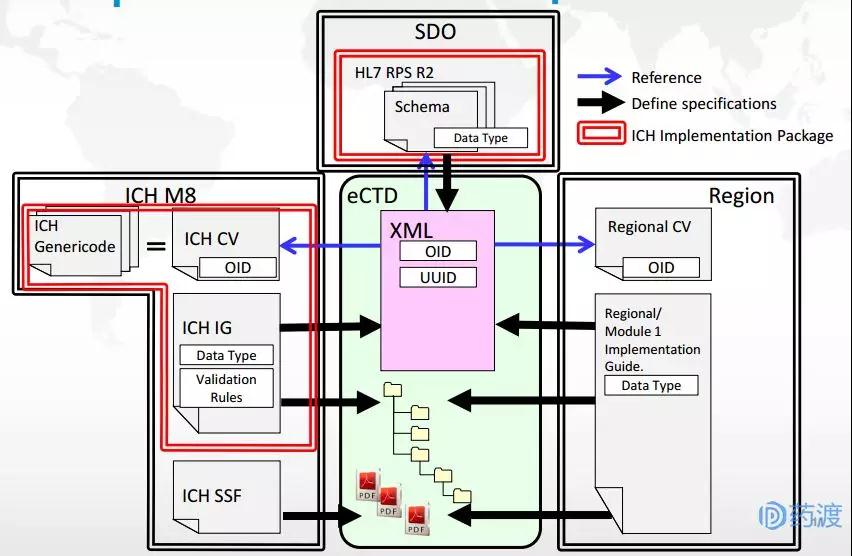
图2 eCTD v4.0相关组成信息
常见的eCTD缺陷及注意事项
电子文档的编制和准备是个极其复杂和繁琐的过程。在生成定稿电子申报文件之前,注册团队除了需要对申报资料内容进行重重审核外,还需要对电子文档的系统功能进行反复检验,以确保申报内容及电子文件的书签、链接的准确性。后期的工作对注册团队要求也较高,必须具备广泛的专业知识及熟练的计算技能。
如今FDA对各厂家申报文件的审查越发的严格,出现10个微小缺陷及1个重大缺陷,即拒绝接收申报文件,例如批记录或图谱中出现未翻译的中文即有可能被FDA认为是重大缺陷而退审,不但从经济上造成企业的重大损失,也从时间上耽误了上市的有利时机。故了解当前eCTD常见缺陷及问题便很有必要。
当前,常见的eCTD缺陷包括如下:1)文件中带有未翻译的中文;2)图片、图谱不清晰;3)PDF书签(a.未对超过5页的PDF编制书签/b.书签不够详细/c.书签的名称不准确);4)交叉索引及超级链接(a.未编制索引或链接/b.索引或链接失效或无效/c.文件目录无链接/d.链接未标示成蓝色字体)。
小结
相信经常参与申报工作的同仁会有较多体会,无论是药品注册相关的CTD,还是一些纵向基金的申请,文本的完善就已经让人非常消耗脑细胞了,再加上一些不完善的网络系统(有时候一个逗号的错误输入都会导致“卡壳”),就更加崩溃了。故对于eCTD,笔者的感觉是,大多数国内药品研发单位及相关工作人员,当前还不需要过多的深入研究,毕竟其还未彻底完善,离大范围的实施也还比较遥远...不过,笔者承认,药品注册相关eCTD的普及,终究会是一种必然,故简单的了解下,还是很有必要的。
参考:
1.http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Multidisciplinary/M8/M8_REVISED_Concept_Paper_for_eCTD_v1.3c_9Dec2015.pdf.
2.http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Multidisciplinary/M8/M8_eCTD_Concept_Paper.pdf.
3. http://estri.ich.org/new-eCTD/eCTDv4_0_SupportDocumentation_v1_2.pdf.
4. http://estri.ich.org/new-eCTD/index.htm.
5. eCTD格式申报资料模式的探讨与展望
6. CTD格式文件在化学仿制药注册中的实践和改进
7. CNKI其他部分文献
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx