“注射剂特别是静脉注射剂,属于高风险剂型,必须严格监管。”昨天(10月10日),国家食药监总局局长毕井泉在全国药监系统电视电话会议上,再次强调注射剂再评价工作,并“喊话”相关药企:“这件事谁早做谁主动。”

中办、国办联合印发的<关于深化审评审批制度改革鼓励药品医疗器械创新的意见>,对注射剂的审评审批做了严格的限定_严控口服制剂改注射制剂,口服制剂能满足临床需求的,不批准注射制剂上市;严控肌肉注射制剂改静脉注射制剂;对已上市药品注射制剂进行再评价,力争用5至10年左右时间基本完成。(详见>>健识局<刚刚,中办国办联合发文:注射剂迎“生死风暴”;药代卖药违法!>)
对于屡曝安全性风险,且在医保控费的医改大背景下,多地多次被重点监控,甚至被“踢”出基层医保目录的中药注射剂,毕井泉没有具体展开,但值得注意的是,他在发言中提出:药品医疗器械监管领域存在的突出问题,特别是多组分生化药、中药提取物和低于成本价中标的药品,要加强现场检查和质量抽检,消除风险隐患,确保公众用药安全。
中药注射剂,正是中药提取物主要的成药表现形式。
中药注射剂不良反应全梳理
清开灵、双黄连、参麦多年“排行”居首
在本轮医改、药改的双重政策压迫下,那些昔日创造“销售神话”的中药注射剂,甚至写入重大疾病国家版治疗指南的“独家品种”,究竟要往何处去?
健识局从最近一次江西青峰喜炎平注射液和山西振东安特红花注射液被CFDA责令“全国停产、停售”的危机切入,详尽梳理2008年至今,国家食药监总局和国家药品不良反应监测中心联合发布在的所有中药注射剂不良反应通报,以飨诸君。
9月23日,CFDA通报的喜炎平和红花注射液严重不良反应问题,再次引发对中药注射剂“生死存亡”的大讨论。然而,这只是中药注射剂安全性问题的冰山一角。
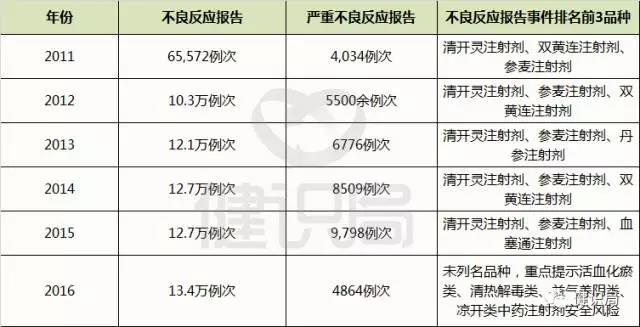
梳理过去6年来的<国家药品不良反应监测年度报告>,可以看到下面这组“惊人”的数据,清开灵注射剂、双黄连注射剂、血塞通注射剂、血栓通注射剂均是不良反应报告中的常客,而处于风暴漩涡中的喜炎平、红花注射液,也不止一次在不良反应通报中“榜上有名”。
2011—2016年全国报告的中药注射剂不良反应情况汇总
上一轮再评价不了了之
不良反应和“销售神话”尴尬并存
CFDA曾于2009年启动过中药注射剂安全性再评价工作。

当年,一系列的文件要求,从风险控制能力评价、风险效益评价、临床研究、质量可控性评价等多方面评价已上市中药注射剂的安全性。在此背景下,灯盏细辛注射液、疏血通注射液、参麦注射液、双黄连注射液、注射用血塞通、红花注射液、清开灵注射液、参芪扶正注射液等中药注射液大品种纳入再评价重点。
但遗憾的是,此次再评价似乎不了了之,最终官方没有通报任何品种的再评价结果,也没有中药注射剂因此次再评价工作,受到退市,或修订说明书、整改生产工艺的处罚。从历年<国家药品不良反应监测年度报告>可以看出,2011年后,中药注射剂的不良反应报告、严重不良反应报告/事件“绝对数”,都在递增。
另一方面,2009年到2014、2015年之间,是中药注射剂的市场大“爆发”。
据财新网报道,国内已通过国家质量标准的中药注射剂超过140种,生产企业近400家。
据前瞻产业研究院2015年统计,中药注射剂近5年来的复合增长率约为22%,虽较之前30%的增长速度有所下降,但仍高于中成药15.78%和整个药品市场18.23%的收入增长速度。
从A股上市药企持有的中药注射液大品种2015年销售情况看,米内网统计,排名前7位的参芪扶正注射液、血必净注射液、痰热清注射液、热毒宁注射液、参芎葡萄糖注射液、注射用血栓通和艾迪注射液,当年销售量均超10亿元。
江西青峰药业的独家品种喜炎平注射液,更是创下独特的“销售神话“。
2009年后,在原国家卫生部发布的<手足口病诊疗指南>、<甲型H1N1流感诊疗方案>及<发热伴血小板减少综合症防治指南>中,喜炎平均被列为推荐用药。
2011年,喜炎平的销售额突破10亿元,并呈逐年攀升之势,最高峰时年销售额曾突破20个亿,还被纳入多省基药目录。
但同时,喜炎平又不断在各地被报告出现严重不良反应。2014年,新浪微博认证为广东深圳市儿科副主任医师的网友“drpeihg”还曾经发帖举报,喜炎平未经临床药物试验,药效不确定,不良反应频发,且不良反应高发于儿童,却被大量应用于儿科。激起医药界和舆论震动。
新一轮“再评价”5-10年
中药注射剂会“消亡”吗?
在新一轮医改、药改的大背景下,中央深改小组审议通过,中办、国办联合印发的<关于深化审评审批制度改革鼓励药品医疗器械创新的意见>中,提出要用5—10年事件,完成注射剂进行再评价工作,显然比2009年,由原国家食药监局一个部门之力,发起的中药注射剂再评价,力度要大;明确的“5-10年“时间限定,也显得更加从容,可执行。
从本届政府的改革力度上看,此轮中药注射剂的再评价,势在必行。关键是何时正式启动?如何执行?重点是谁?
国家食药监总局副局长吴浈9日公开表示,方案已初步形成,将公开征求意见。(详见>>健识局:颠覆药械行业的两办<创新意见>,CFDA为你划重点!)毕井泉在昨天的全系统会议上又进一步明确注射剂再评价的主要内容_对过去已批准上市的注射剂,要求批准文件持有人进行成分、机理、临床疗效的研究,(再)评价其安全性、有效性和质量可控性。
“总局将尽快明确注射剂再评价的方式方法和时间步骤。希望各地组织相关企业及早开展研究。这件事谁早做谁主动。”毕井泉还在这段发言最后,“喊话“相关企业。
而健识君认为,9月23日,CFDA关于山西振东安特红花注射液和江西青峰喜炎平注射液质量问题的通告(2017年第153号)中,提出的“热原”问题,将是中药注射剂再评价的一个重点。
热原有细菌性热原(如内毒素)、内源性高分子热原、内源性低分子热原及化学热原等。
如果不良反应的热原是内毒素,那么热原则是由生产不规范导致的,可通过GMP检查来监管。
如IFN、IL-6等药物就是内源性热原。而中药注射液也存在这种可能,药物本身就是热原。这种情况下,就需要对药物进行重新评估,因为用药后导致患者发热的可能很大,从其疗效评估,是否有必要急需应用此药物。
传统中药是临用前煎煮。中药注射液若选择溶液的形式,存在药物在水中降解的可能,降解物有可能为热原。
GMP第二百二十五条规定,每批药品的留样数量至少应当能够确保按照注册批准的质量标准,完成两次全检(无菌检查和热原检查等除外)。据此规定,药厂可能漏掉对降解后产生热源可能性的检测。
此外,可见异物,不仅是中药注射剂,也是其他注射剂常见的质量问题。
可见异物的产生,最大的可能就是生产不规范。中药注射的原料是中药材,而中药材质量的稳定性要比化药、生物制品原料药差。加强产品检测的力度是控制可见异物的关键。可见异物的检查方法主要是通过人工灯检,除了实验室抽样检测之外,生产企业会对出产的每一支药品进行灯检,其中确实存在人工标准不一致或犯错的风险。
如果按照毕局长在电视电话会议中所说,会尽快明确注射剂的再评价方式方法和时间步骤,并重点加强对中药提取物的现场检查和质量抽检。那么,中药注射剂被广泛质疑的“不良反应频发”,哪些是药物本身的问题,哪些是生产不规范或临床使用不合理的问题,终将“水落石出”。
最后,还是那句话,药品的安全性、有效性、可及性,都是是关乎民生的大事,不能倒洗澡水,把孩子一起倒了。也不能以中药在古代没有注射剂为由,否定中药注射剂,以内,西药注射剂,同样是近现代产物。
通过再评价,不合适做成注射剂型的中药,该撤就撤;如果证实,部分品种的中药注射剂,确实有显著的临床疗效,且其不良反应问题,只是少数企业不规范生产导致的安全性事件,可以对违规企业整改、关停,同时保护正规生产企业的利益。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx