1月5日-6日,CFDA官网连续发布了三条对药企的检查通报,涉及的企业分别是湖北潜江制药股份有限公司、上海庆安药业集团宿州制药有限公司与安国市祁澳中药饮片有限公司。
其中,在对湖北潜江制药股份有限公司的跟踪检查中发现,其存在违反<中华人民共和国药品管理法>及药品GMP相关规定的行为,CFDA要求湖北省食品药品监管局收回该企业相关剂型<药品GMP证书>(CN20150016),对该企业违法违规行为开展立案调查,监督企业对相关产品采取风险管控措施。
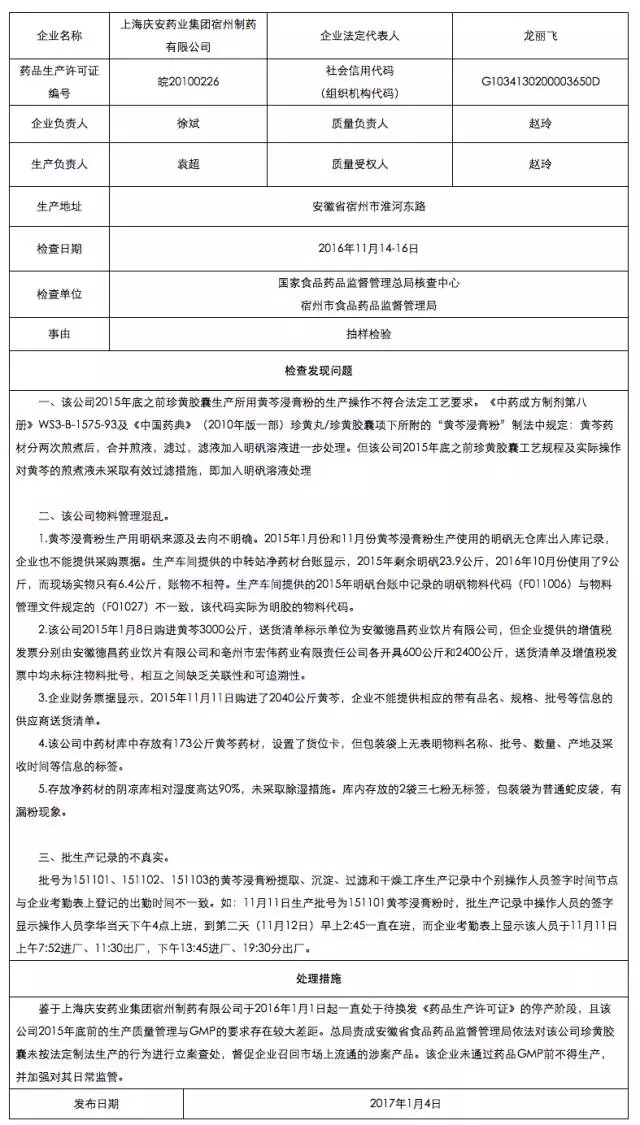
在对上海庆安药业集团宿州制药有限公司的飞行检查中发现,该公司存在珍黄胶囊未按法定制法生产、物料管理混乱、批生产记录不真实等问题,鉴于其于2016年1月1日起一直处于待换发<药品生产许可证>的停产阶段,且该公司2015年底前的生产质量管理与GMP的要求存在较大差距。CFDA责成安徽省食品药品监督管理局依法对该公司珍黄胶囊未按法定制法生产的行为进行立案查处,督促企业召回市场上流通的涉案产品。该企业未通过药品GMP前不得生产,并加强对其日常监管。
在对安国市祁澳中药饮片有限公司的飞行检查中发现,该企业存在涉嫌外购中药饮片贴牌销售、数据可靠性存在真实性问题、质量受权人和生产部负责人履职不到位等问题,违反了<药品生产质量管理规范>有关规定,CFDA责令河北省食品药品监督管理局依法收回该企业药品GMP证书,并对有关违法行为立案查处。
详情>>>
对湖北潜江制药股份有限公司跟踪检查通报

(点击图片可放大)
对上海庆安药业集团宿州制药有限公司飞行检查通报
(点击图片可放大)
对安国市祁澳中药饮片有限公司飞行检查通报

(点击图片可放大)
■来源/CFDA官网
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx