国家卫生计生委、工业和信息化部、食品药品监管总局5月31日联合发布了<首批鼓励研发申报儿童药品清单>。该份清单主要涉及32种药品,基本上都是口服溶液、注射剂、糖浆剂等符合儿童用药特点的儿童专用剂型。医药魔方之前曾对这份名单下可能受益的企业、以及好品种进行过分析。
首批鼓励研发申报儿童药品清单
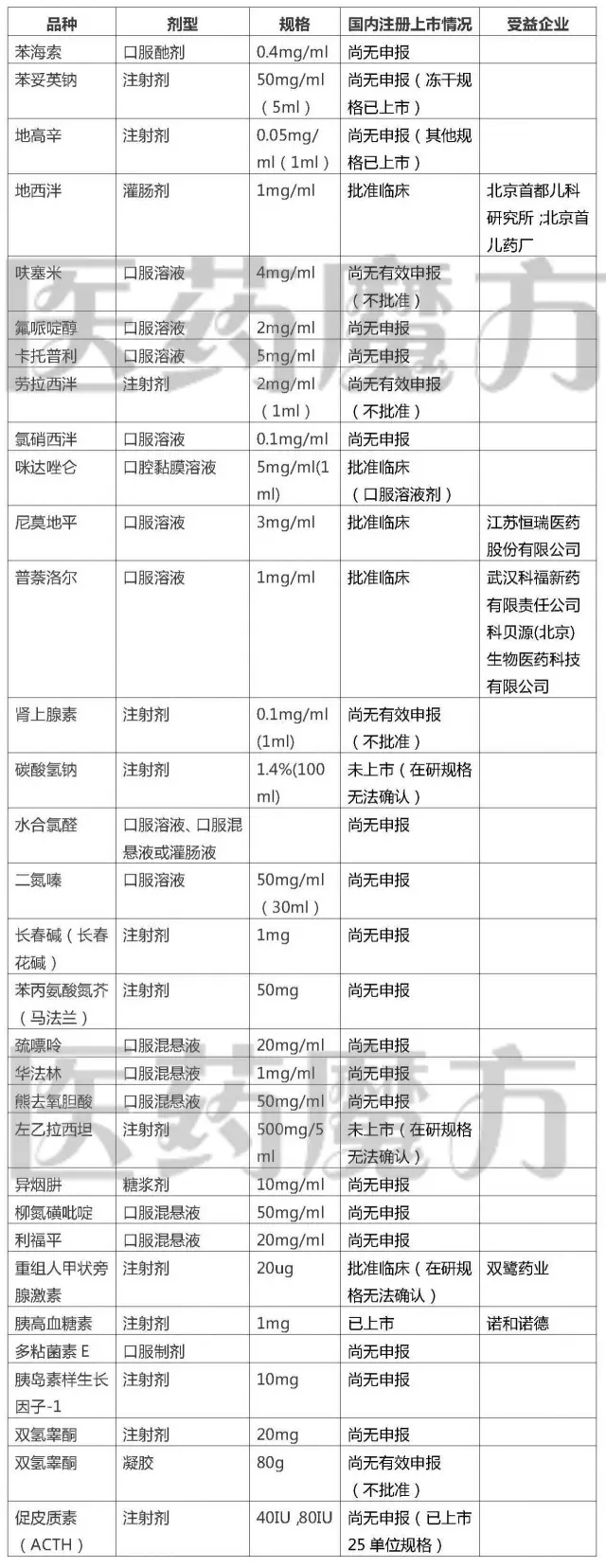
注:药品适应症应包括儿科适应症或具备儿童用法用量
11月14日,广东省卫生计生委、广东省经济和信息化委、广东省食品药品监管局三部门联合转发了<关于印发首批鼓励研发申报儿童药品清单的通知>,明确表示对清单上所列的儿童药,给予特殊审批程序处理,从研发到销售给予“及时指导、随到随审、加快审批、鼓励生产、优先采购”一条龙的优惠扶持。具体如下:
针对儿童药品开发困难、儿童专用药品稀少、成人药物超标签用于儿童等临床常见问题,国家在政策上对儿童药研发的倾斜和鼓励越来越多,而且慢慢落在实处。
2015年12月21日,CFDA发布了第一批实行优先审评审批的儿童用药注册申请名单(见:儿童药优先审评:机会 or 鸡肋?)。
2016年1月29日,CDE发布了<临床急需儿童用药申请优先审评审批品种评定的基本原则>(见:CDE公布最终名单:儿童药是否优先审评很大程度取决于是否首家申报!)
2016年3月8日,CFDA发布了<儿科人群药物临床试验技术指导原则>(见:请准备好孩子,儿童药临床试验指导原则来了!)
2016年5月31日,三部委组织制定了<首批鼓励研发申报儿童药品清单>(见:卫计委/CFDA鼓励研发申报32种儿童药品(附申报情况、受益企业名单))。
广东作为医药大省,其对儿童药研发的态度很可能对其他各省、市起到示范作用,儿童药研发迎来千载难逢的好机遇,如果国内药企能够积极响应“药品研发以满足临床需求为导向”的政策,掘金的机会真有很多。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx