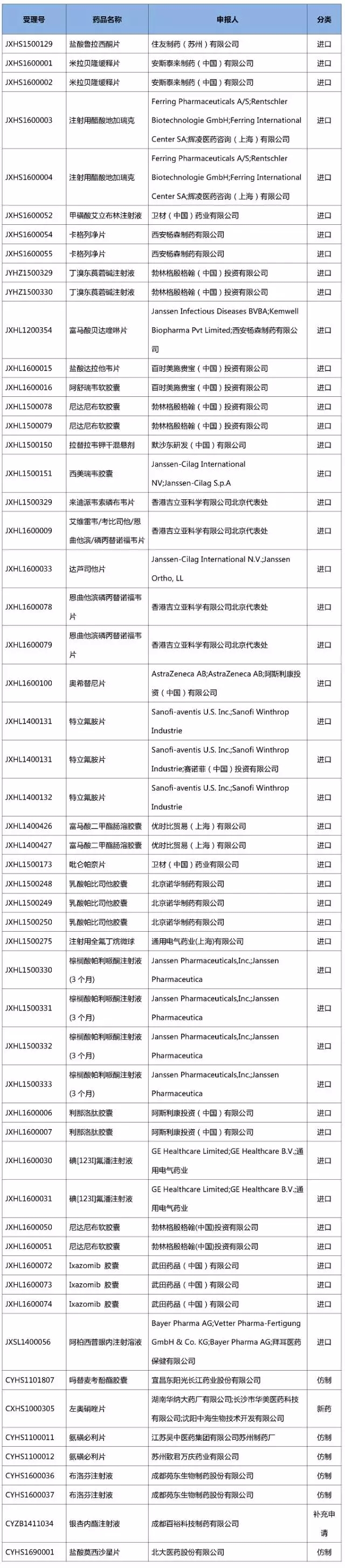
自7.22临床自查以来,CFDA先后发布了4张<关于药物临床试验数据自查核查注册申请情况的公告>,具体日期以及涉及的受理号数量如下表:
|
文件编号 |
受理号数量 |
公布日期 |
|
2015年第117号 |
1622 |
2015.7.22 |
|
2016年第81号 |
181 |
2016.4.1 |
|
2016年第142号 |
82 |
2016.9.1 |
|
2016年第171号 |
55 |
2016.11.4 |
因为CFDA在历次公告中的口径均是“收到**个已完成临床试验申报生产或进口的药品注册申请,决定对这些注册申请进行药物临床试验数据核查”,而且第一批1622个受理号的前4位字母也都以“S”结尾,大家一般都认为列入临床数据自查核查的品种都是已经做完临床试验报产、通过自查核查就能上市的品种。
所以当第4批55个临床数据自查公告发布以后,很多人一看到里面有37个前4位字母也以“L”结尾的受理号,就感到不太理解,也有些不明就里的网友甚至还以为Harvoni、AZD9291等重磅新药被列入自查核查,是马上要在中国上市的节奏^
医药魔方微信后台收到不少网友留言咨询这个问题,今天特地在此简单解释一下。
其实,对于外企进口新药注册申请的临床数据核查,以“L”结尾的受理号在第2批(2016年第81号)临床自查清单中就已出现,只不过当时数量较少,没有引起大家注意。
总局关于药物临床试验数据自查核查注册申请情况的公告(2016年第81号)

等第4批临床数据核查名单公布的时候,已经有37个以“L”结尾的受理号集中出现。
总局关于药物临床试验数据自查核查注册申请情况的公告(2016年第171号)
回答这个问题需要从进口药品注册的“三报三批”说起。
CFDA鼓励外企在中国开展国际多中心临床试验,但尚未支持直接拿国际多中心临床试验数据来申报上市,执行三报三批。第一,申报国际多中心临床试验(IMCT或MRCT),获得CTA批件。第二,申报验证性临床(IND),获得临床批件;第三,申报NDA,获得进口文号。
对于第4批37个以“L”结尾的进口药品受理号,它们申报的都是验证性临床,之所以被纳入临床数据自查,只是因为不太凑巧赶上了国家这波临床整顿,此次核查的是它们已经完成的国际多中心临床试验中国区的临床数据。
换句话说,核查清单中出现的前4位字母以L结尾的受理号,所涉及的药品也都是在中国开展过国际多中心临床试验的。所以,这些受理号涉及的品种在通过临床数据核查后不是批准上市,而是拿到IND批件,同意免临床,再直接申报NDA,它们距离上市还是隔着一道报产程序的。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx