4月1日,CFDA官网发布<关于药物临床试验数据自查核查注册申请情况的公告>(2016年第81号)。详文如下:
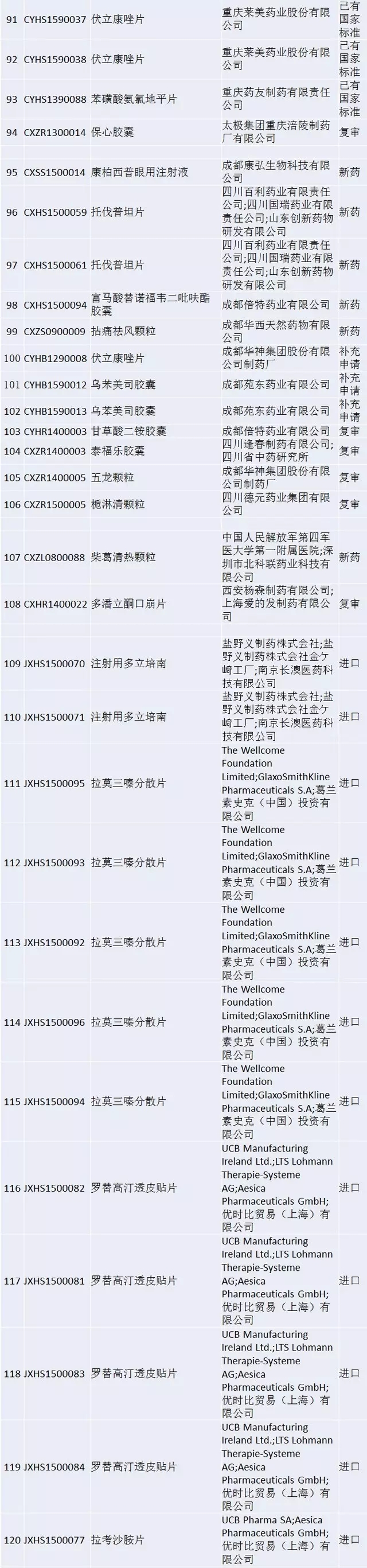
2015年7月22日<关于开展药物临床试验数据自查核查工作的公告>(国家食品药品监督管理总局公告2015年第117号)发布后,国家食品药品监督管理总局(以下简称总局)新收到256个已完成临床试验申报生产或进口的药品注册申请,截止到2016年4月1日,药品注册申请人已主动撤回其中的75个注册申请,总局决定对剩余的181个注册申请逐一进行药物临床试验数据核查。有关事宜公告如下:
一、在总局组织核查前,药品注册申请人自查发现药物临床试验数据存在真实性问题的,应主动撤回注册申请,总局公布名单,不予追究责任。
二、总局食品药品审核查验中心将在其网站公示现场核查计划,并告知药品注册申请人及其所在地省级食品药品监管部门,公示10个工作日后食品药品审核查验中心将通知现场核查日期,不再接受药品注册申请人的撤回申请。
三、总局将对药物临床试验数据现场核查中发现数据造假的申请人、药物临床试验责任人和管理人、合同研究组织责任人从重处理,并追究未能有效履职的省级食品药品监管部门核查人员的责任。





■来源/CFDA官网
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx