开展仿制药质量一致性评价,全面提高仿制药质量是<国家药品安全“十二五”规划>的重要任务,是持续提高药品质量的有效手段,对提升制药行业整体水平,保障公众用药安全具有重要意义。<国务院关于改革药品医疗器械审评审批制度的意见>中提及要加快仿制药质量一致性评价,力争2018年底前完成国家基本药物口服制剂与参比制剂质量一致性评价。在规定期限内未通过质量一致性评价的仿制药,不予再注册;通过质量一致性评价的,允许其在说明书和标签上予以标注,并在临床应用、招标采购、医保报销等方面给予支持。质量一致性评价工作首先在2007年修订的<药品注册管理办法>施行前批准上市的仿制药中进行。
舆论中,一致性的进度条似乎突然就加快了,似乎国务院此文一出就有许多产品的一致性评价都做完了。实际上国务院不过是再一次重申一致性评价责任是企业负责的,且有意让企业自主发起一致性评价方法、标准及有关技术指导原则等方案的制定。此前2013年2月16日发布的<国家食品药品监督管理局关于开展仿制药质量一致性评价工作的通知>中提及的“国家食品药品监督管理局组织相关技术部门及专家,按照给定的评价方法和标准,对药品生产企业提出的仿制药自我评估资料进行评价,评判其是否与参比制剂在内在物质和临床疗效上具有一致性。药品生产企业是开展仿制药质量一致性评价的主体。应按照公布的评价方法、标准及有关技术指导原则,以参比制剂为对照药品,全面深入开展与参比制剂的对比研究,解决影响仿制药内在质量的关键问题,实现与参比制剂在内在物质和临床疗效方面的一致”,则是一致性评价的责任在企业,标准和方法论主要由国家层面包揽,企业可以负责起草个别品种的质量一致性体外评价方法和标准,但需要仿制药质量一致性评价工作办公室组织药品检验机构进行复核,符合要求的,经公示及专家审查后对外公布。企业需按照国家公布的评价方法、标准及有关技术指导原则,以参比制剂为对照药品,全面深入开展与参比制剂的对比研究,解决影响仿制药内在质量的关键问题,实现与参比制剂在内在物质和临床疗效方面的一致。
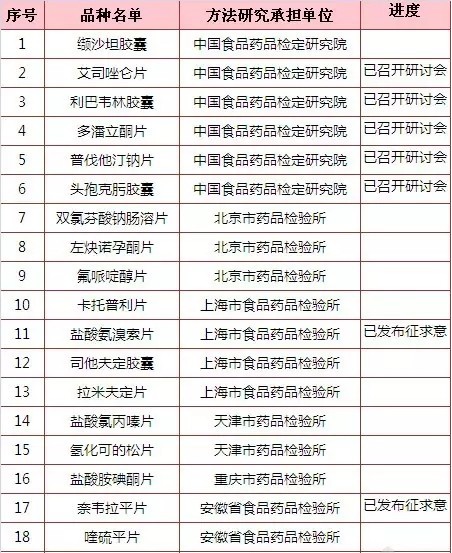
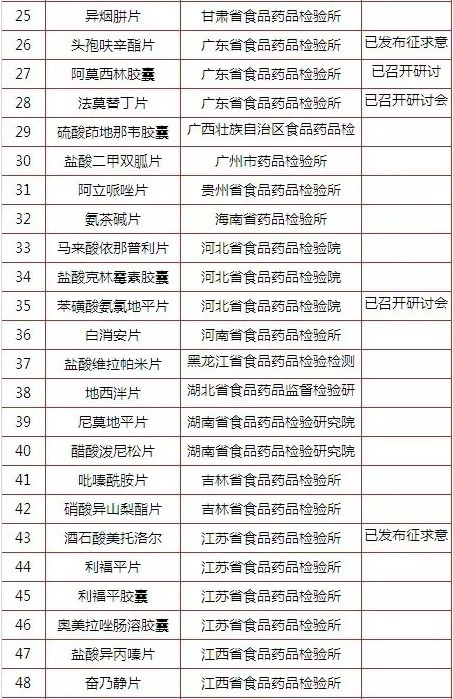
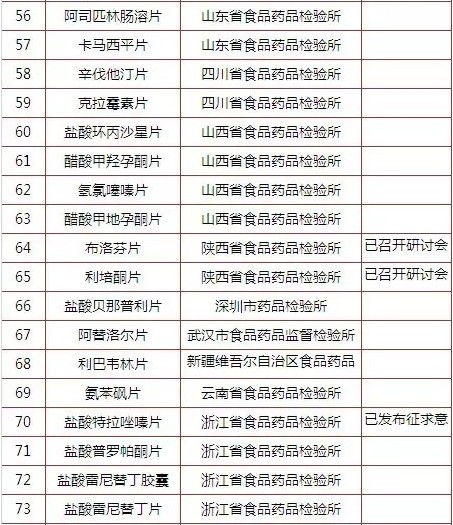
究竟有多少产品做了一致性评价呢?能拿60分及格分绝不拿61分的国内药企而言,会主动参与的很少,毕竟没有利益推动。国家层面,按<国家食品药品监督管理局关于开展仿制药质量一致性评价工作的通知>,一致性评价的对象是2007年10月1日前批准的、对在国内外上市药品进行仿制的化学药品。同年发布<国家食品药品监督管理总局办公厅关于2013年度仿制药质量一致性评价方法研究任务的通知>公布了75个产品的一致性评价品种名单和方法研究承担单位汇总表。
如下表所示,中国食品药品检定研究院在2013年12月31日发布了关于征求<普通口服固体制剂溶出曲线测定与比较指导原则(草案)>意见的通知和关于征求<口服固体制剂参比制剂确立原则(草案)>意见的通知后,已发布征求意见的产品有5个,分别为盐酸氨溴索片、奈韦拉平片、头孢呋辛酯片、酒石酸美托洛尔和盐酸特拉唑嗪片。艾司唑仑片、利巴韦林胶囊、多潘立酮片、普伐他汀钠片、头孢克肟胶囊、阿莫西林胶囊、法莫替丁片、苯磺酸氨氯地平片、阿苯达唑片、氯雷他定片、布洛芬片和利培酮片12个产品还在研讨会阶段,还有58个产品进度未明。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx