当地时间 11 月 24 日,诺华宣布,FDA 已批准 Onasemnogene abeparvovec 鞘内注射液(OAV101 注射液,Zolgensma,Itvisma®)用于治疗两岁及以上、患有脊髓性肌萎缩症(SMA)且经确诊携带 SMN1 基因突变的儿童、青少年和成人。根据诺华新闻稿,这是目前首个也是唯一一个可用于治疗此类广泛人群的基因替代疗法。Zolgensma 的独特设计在于通过一次性固定剂量治疗 SMA 的根本遗传病因,无需根据年龄或体重调整剂量。通过替换 SMN1 基因,Zolgensma 可以改善运动功能,有望减少其他现有疗法中常见的长期用药需求。
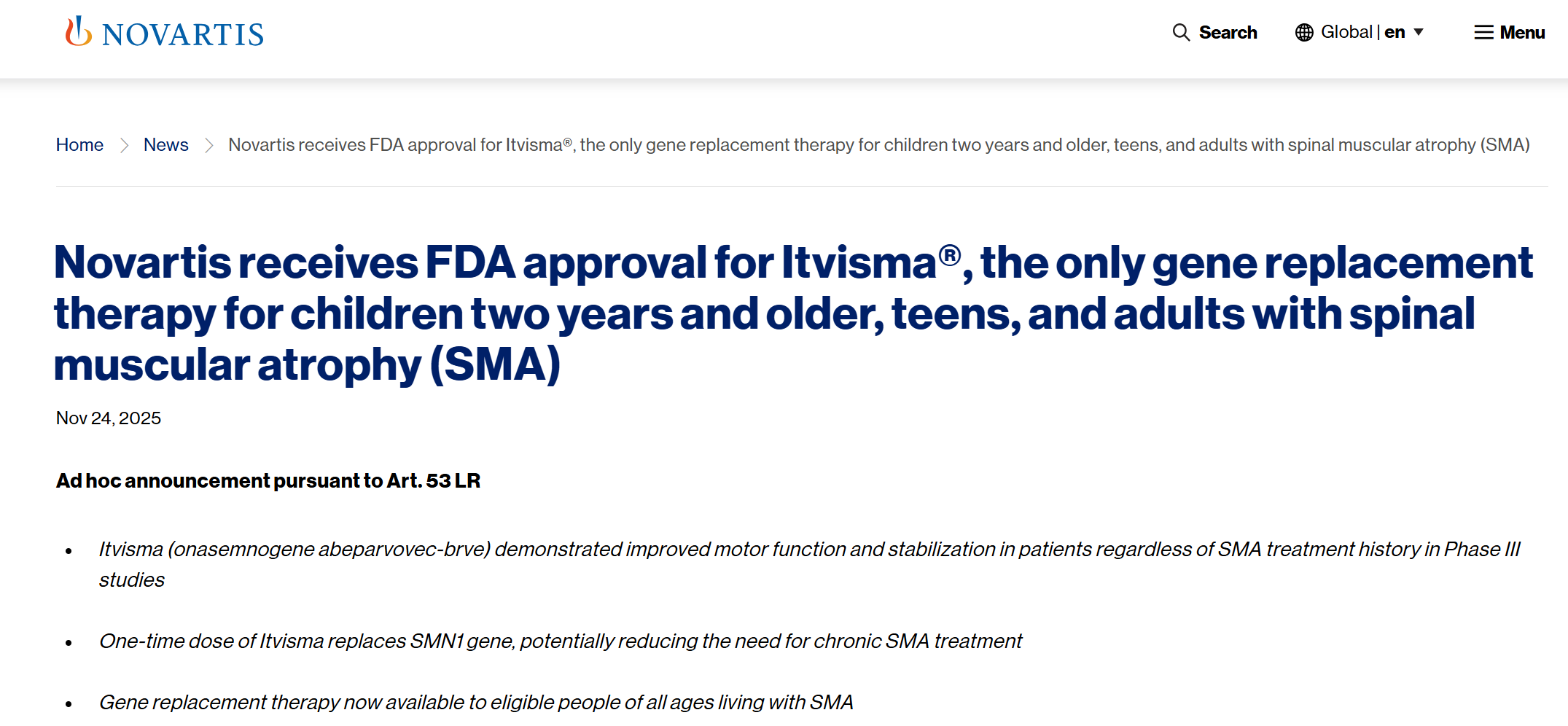 截图来源:诺华官网
截图来源:诺华官网
Zolgensma 是一款针对 SMA 的基因疗法,通过单次静脉注射即可实现持续的 SMN 蛋白表达,从而阻止疾病进展。这是诺华在 2018 年以 87 亿美元收购 AveXis 公司获得的产品,在 2019 年 5 月首次获 FDA 获批上市,用于两岁以下 I 型 SMA 患者。
此前诺华披露,其针对 Zolgensma 研发的总投入达到了 94 亿美元(约合人民币 669 亿元),研发成本巨大。相对的,Zolgensma 的定价也并不便宜,以每剂 210 万美元(约合人民币 1495 万元)的价格上榜「全球十大最贵药物」,位列第 9。
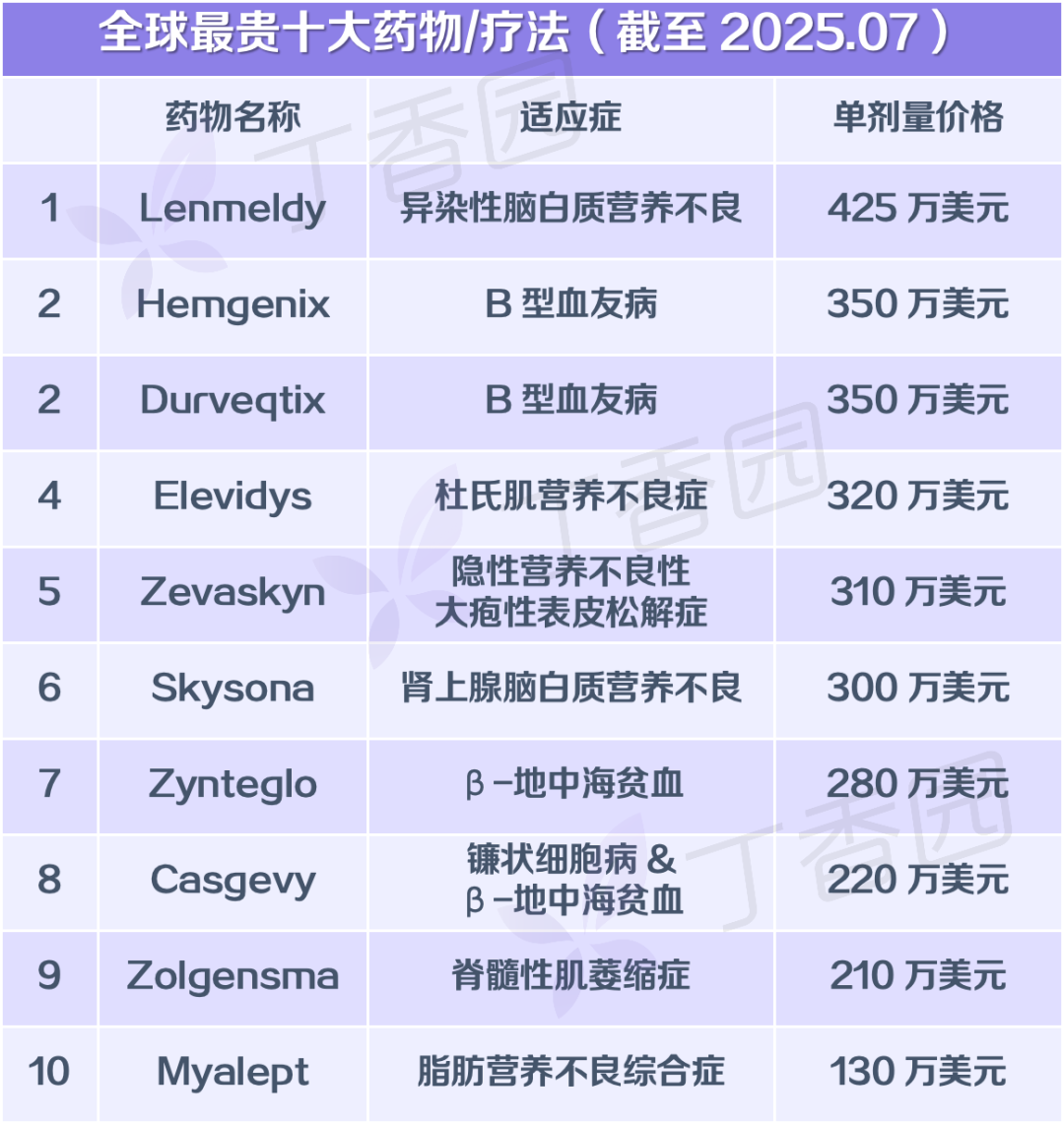
截图来源:丁香园整理
从销售额角度来看,Zolgensma 上市后第一季度销售额就达到了 1.6 亿美元,2021 年销售额高达 13.51 亿美元,2022 年销售额进一步上涨到 13.7 亿美元,2024 年销售额为 12.14 亿美元。
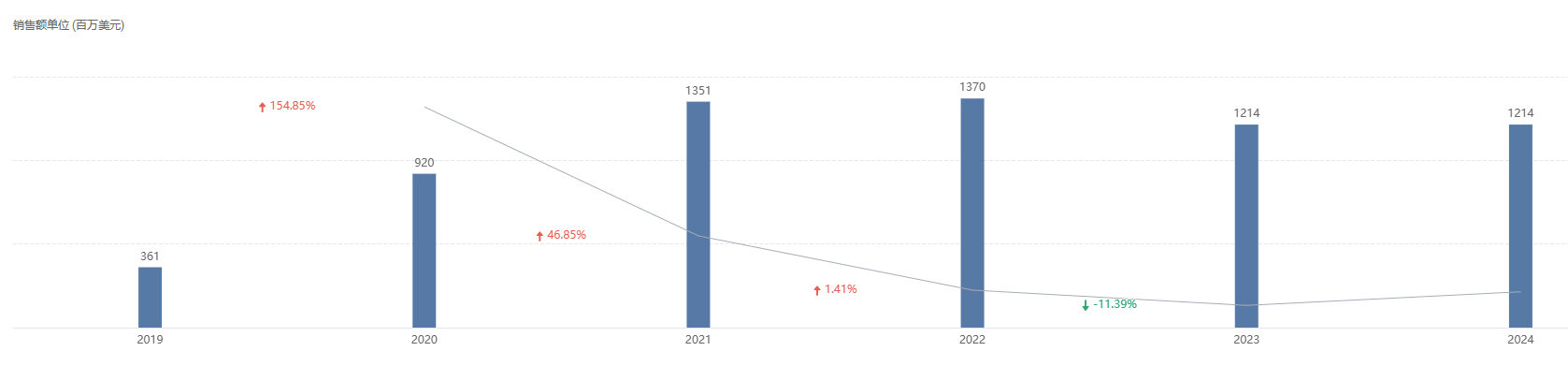 截图来源:Insight 数据库
截图来源:Insight 数据库
此次批准是基于全球 III 期临床 STEER 研究(NCT05089656)的积极结果,并得到了开放标签 IIIb 期 STRENGTH 研究的支持。
结果显示,接受 Zolgensma 治疗患者显示出在运动功能方面具有统计学显著的改善,并实现在疾病自然病程中通常难以观察的运动能力,且疗效在 52 周随访中得以维持。
此外,Zolgensma 安全性良好,在两个研究中不良事件的发生情况一致。STEER 研究中最常见的不良事件为上呼吸道感染和发热,而 STRENGTH 研究中最常见的不良事件包括普通感冒、发热和呕吐。
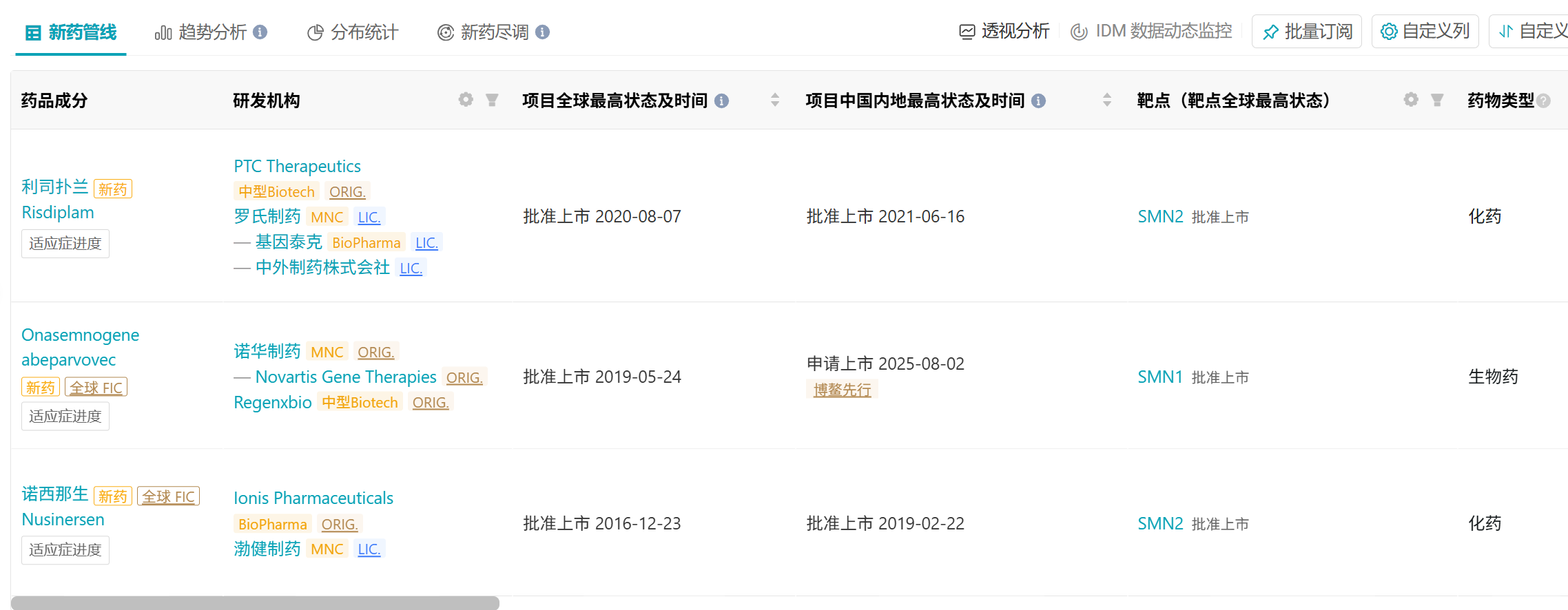
Insight 数据库显示,目前全球范围范围内,SMA 新药仅获批 3 款,分别是 PTC Therapeutics 的利司扑兰、Ionis Pharmaceuticals 的诺西那生和诺华的 Zolgensma。值得一提的是,其余 2 款均为化药,仅诺华 1 款为基因治疗药物。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx