百亿明星药的首仿之争愈加激烈。
近日,石药集团欧意药业提交的布瑞哌唑片4类仿制上市申请已获得国家药品监督管理局药品审评中心(CDE)承办,加码精神分裂症治疗领域的市场竞争,标志着这款明星大单品的首仿争夺战进入到白热化阶段。
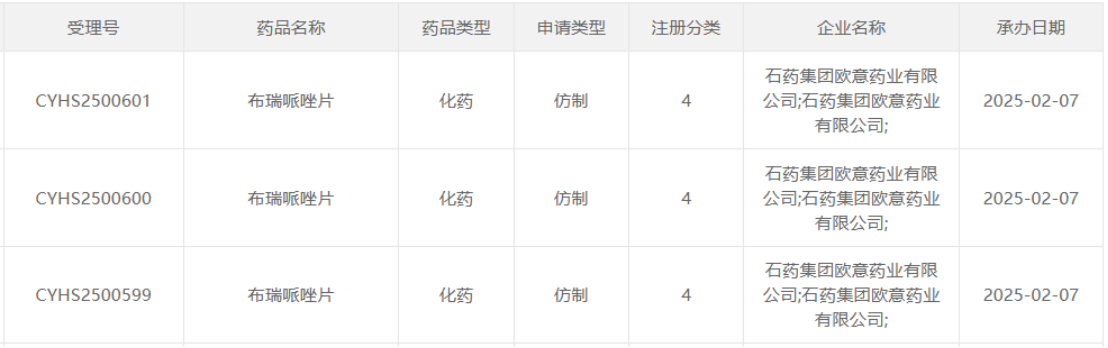
作为全球首个上市的多巴胺部分激动剂(DPA)迭代产品,布瑞哌唑凭借更优的疗效和安全性,改变了临床实践,正成为跨国药企与本土龙头竞逐的焦点。石药集团等一批国内头部药企的加速入局,不仅搅动了原研药企大冢制药的“护城河”,更让市场对国产替代进程的提速充满期待。
在精神疾病负担日益沉重的当下,国产布瑞哌唑片的到来,或将加速优质治疗方案的普惠进程,重塑国内抗精神病药物的市场版图。而谁能在布瑞哌唑片的首仿争夺中拔得头筹,无疑将占据市场先机,获得巨大的商业利益。
多适应症加速叠加
布瑞哌唑再攀高峰
精神分裂症是一种常起病于青壮年的精神疾病,会让患者饱受感知觉、思维、情感和行为等多重障碍的折磨。因病程迁延、反复发作,精神分裂症极易导致患者精神残疾。为了治疗这一顽疾,抗精神病药物不断研发迭代,以阿立哌唑、卡利拉嗪为代表的第三代抗精神病药物,凭借其化拮抗为部分激动的机制,进一步减少了不良反应,成为临床治疗的主力军。
而由日本大冢制药和丹麦灵北制药共同研发的布瑞哌唑(brexpiprazole)作为阿立哌唑的迭代升级产品,更是展现了其独特的魅力。相较于阿立哌唑,布瑞哌唑对5-HT1A、5-HT2A、5-HT7受体具有更高的亲和力,能更好地发挥临床疗效;同时,其对D2受体的内在活性较低,避免了D2受体的过度阻断或激活,从而带来抗精神病作用,并降低了锥体外系反应等副作用的理论风险。
布瑞哌唑的强效还体现在其对5-HT2A受体的拮抗效应上,这一特性不仅增强了其抗精神病疗效,还改善了阴性症状,减少了运动副作用和高泌乳素血症。此外,布瑞哌唑对5-HT1A受体具有部分激动效应以及对多巴胺D3受体也有一定的亲和力,有助于改善阴性、情感、认知症状。值得一提的是,布瑞哌唑与组胺H1受体和毒蕈碱M1受体亲和力较弱,从而降低了过度镇静及抗胆碱能副作用的风险。
临床试验显示,布瑞哌唑的锥体外系反应(EPS)和代谢综合征发生率显著低于奥氮平等二代药物,且对阴性症状的改善更为优越。基于在疗效和安全性上较传统药物展现出的显著优势,布瑞哌唑最早于2015年7月在美国率先上市,用于治疗精神分裂症和抑郁症。随后,该药物在2018年先后在欧盟和日本获批上市,并在2024年6月底登陆中国市场。
根据灵北制药与大冢制药的财报,2023年布瑞哌唑的全球销售额达到了22.72亿美元,较上年增长13%。值得一提的是,2023年5月,布瑞哌唑片还成为首个获美国FDA批准用于治疗阿尔茨海默病痴呆相关激越(AADAD)的药物。激越是阿尔茨海默病痴呆患者的典型症状之一,约半数阿尔茨海默病患者会出现激越症状,这为布瑞哌唑提供了又一个显著的增长机会。
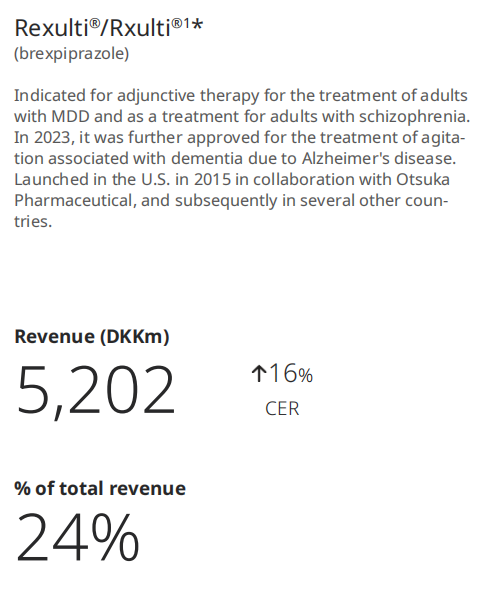
灵北制药最新财报显示,布瑞哌唑在2024年为其创造了52.02亿丹麦克朗(约合7.55亿美元,按2024年平均汇率0.1451计算)的收入,同比增长16%(按固定汇率CER计算),占其总营收的24%。灵北制药在财报中坦言,AADAD适应症目前占美国对布瑞哌唑需求的19%,其认为这一趋势将继续下去,预计该药的峰值销售额将达到10亿美元。而布瑞哌唑全球的销售额,还有待大冢制药的财报揭晓。
作为一款精神疾病领域的重磅产品,布瑞哌唑仍处于市场快速增长的阶段,其还有更多潜力等待释放。2024年12月,大冢制药和灵北制药宣布,布瑞哌唑联合舍曲林(sertraline)治疗成人创伤后应激障碍(PTSD)的3期试验的全部结果已在JAMA Psychiatry上发表。
PTSD是美国最常见的精神疾病之一,在特定年份的PTSD发病率高达约5%。上述研究结果显示,在成人PTSD患者中,与舍曲林加安慰剂治疗相比,通过第1~10周DSM-5创伤后应激障碍量表(CAPS-5)总分的变化来衡量,布瑞哌唑联合舍曲林治疗的PTSD症状的改善具有统计学意义。
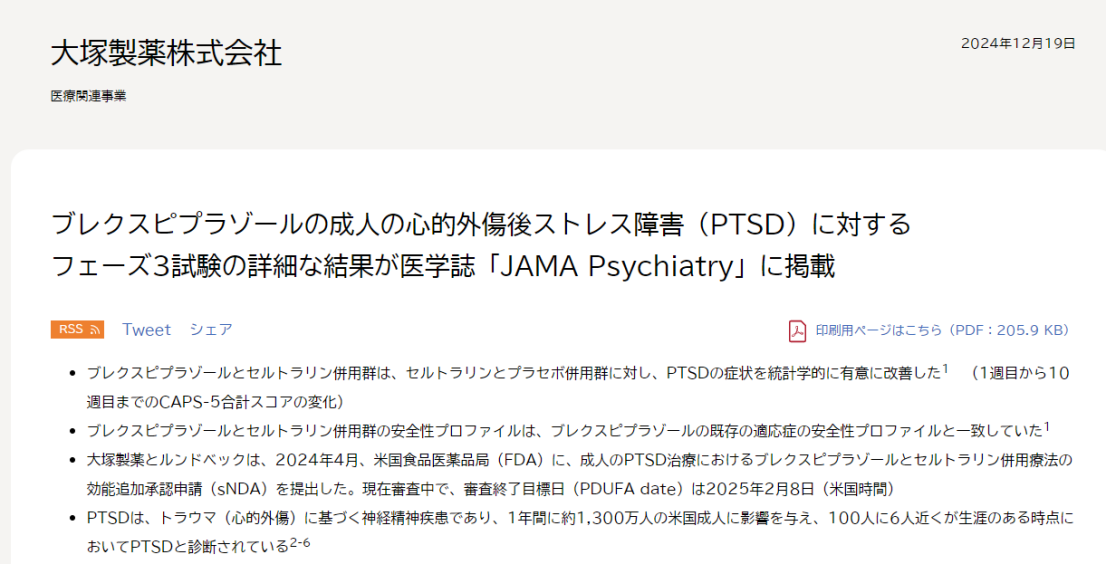
根据新闻稿,大冢制药和灵北制药已经于2024年4月提交了布瑞哌唑联合舍曲林治疗成人PTSD的新适应症上市申请(sNDA)。目前这项sNDA正在接受FDA的审查,PDUFA的目标日期为2025年2月8日。
不过,大冢制药在2025年1月发布公告称,由于FDA的精神药理学咨询委员会(PDAC)的举办日程还没有决定,现在估计会在2025年上半年举办,PDUFA的目标日期将延期至PDAC后。在新适应症的加持下,布瑞哌唑有望再攀新的销售峰值。
超20家药企竞速首仿
百亿市场争夺战打响
在全球范围内,非典型抗精神病药市场规模正在持续扩大。据IMS数据显示,2023年全球非典型抗精神病药市场规模已达231.59亿美元。而在国内,米内网数据显示,2024年中国公立医疗机构抗精神病药物市场规模达218亿元,年复合增长率9.6%。有机构预测,随着诊疗率持续提升以及商保覆盖扩大,预计2030年市场规模将突破500亿元。
在这一背景下,兼具疗效优势和多适应症支撑的布瑞哌唑片,被业界视为下一个10亿级品种。不过,根据CDE专利登记平台信息,大冢制药对布瑞哌唑的核心化合物专利(CN103153959B)将于2026年3月到期。国内头部企业早已瞄准了布瑞哌唑的仿制机遇,剑指“首仿+过评”双重红利。
据悉,此番报产的石药集团欧意药业在2022年即启动了BE试验,并在2024年11月完成了生物等效性研究。此次申报若按优先审评通道推进,或可在2026年上半年获批上市,与原研专利到期形成无缝衔接。
值得一提的是,石药集团在精神神经领域的管线布局日趋密集。除布瑞哌唑外,其奥氮平口崩片、阿立哌唑长效注射剂等品种也已获批上市。2024年,石药集团精神类药物营收同比增长37%。此次加码布瑞哌唑片,既是对现有产品矩阵的补充,也凸显了其瞄准高壁垒专科药赛道的战略意图。
事实上,布瑞哌唑的国产化竞赛早已暗流涌动。米内网数据显示,早在2021年就有国内药企申报仿制药上市,目前申报布瑞哌唑片仿制上市并在审的国内药企超过20家,申报布瑞哌唑口崩片仿制上市并在审的国内药企也有8家。

其中,科伦药业和齐鲁制药不仅均报产了布瑞哌唑片、布瑞哌唑口崩片两款仿制药,还都提交了2.2类新药布瑞哌唑口溶膜的上市申请。据悉,口溶膜具有使用方便,不需要用水送服,置于舌上可迅速溶解等优点,适合儿童、老年患者和吞咽困难的患者服用,能提高患者的顺应性。此外,科伦药业开发的布瑞哌唑长效注射剂亦处于临床试验阶段。
面对这一重磅品种,更多竞争者还在涌入。2月11日,麻醉镇痛药龙头人福医药发布公告称,集团控股子公司宜昌人福药业近日获得国家药品监督管理局签发的布瑞哌唑片《药物临床试验批准通知书》。尽管失去报产优势,但人福医药选择另辟蹊径。据人福医药介绍,其布瑞哌唑片此次获批开展临床的适应症为与其他抗抑郁药联合用于抑郁症治疗,目前国内尚无其他公司获批。

业内分析人士指出,布瑞哌唑片的首仿之争不仅是技术实力的较量,更是企业供应链效率、市场准入能力的综合比拼。随着带量采购常态化,首仿药企有望通过“价格换市场”迅速放量,而后续跟进者或将面临更激烈的价格厮杀。这场超20家药企角逐首仿药的终局,或将重塑国内抗精神病药物市场的权力版图。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx