
GMP指南第6章主要讲的重点是标准物质管理,该章共计可为我们解决近70个关于标准物质管理的问题,滴定液作为自制标准物质,也纳入了本章介绍。
扫码进群领取1300问电子版

什么是标准物质
标准物质系指用于药品质量标准中物理和化学测试用,具有确定的特性和量值,用于鉴别、检查、含量测定、校准设备的物质。按照用途分类包括含量测定用化学对照品、鉴别或杂质检查用化学对照品、对照药材/对照提取物、校准仪器/系统适用性试验用对照品。
► 什么是理化检测用标准物质?
► 理化检测用标准物质分类方法和种类有哪些?
► 什么是含量测定用化学对照品?
► 什么是鉴别或杂质检查用化学对照品?
► 什么是对照药材/对照提取物?
► 什么是校准仪器/系统适用性试验用对照品?
► 什么是生物检测用标准物质?
生物制品
生物检测用标准物质系指用于生物制品效价或含量测定或鉴别、检查其特性的标准物质,其制备与标定应符合《中国药典》三部“生物制品国家标准物质制备和标定”要求。分为国家生物标准品和国家生物参考品两类,国家标准物质是由国际标准物质标定或者或由我国自行研制(尚无国际生物标准品者)。
► 生物制品国家标准物质分几类?
► 什么是国家生物标准品?
► 什么是国家生物参考品?
企业是否可以自制对照品?
对于企业是否可以自制对照品这一事宜,指南给出的答案是肯定的,但是企业自制对照品必须保证自制对照品的准确性,为达到这一目的,企业可以选择相应的活性物质,使用法定标准品或采取准确、可靠的方法进行标化,标化后的物质作为企业 自制工作对照品。
指南还介绍了企业自制对照品的途径和应建立的文件体系,企业自制对照品的途径包括特殊合成工艺单独合成或者正常流程生产、提纯,文件体系包括相应的质量标准、制备方法、鉴别技术、检验和批准、贮存规程。另外每批对照品还均应该用法定标准品进行标化,并制定有效期。
► 企业是否可以自制工作对照品?
► 企业自制工作对照品应建立哪些文件?
► 使用企业自制工作对照品前应注意什么?
► 每批工作对照品是否均需要用法定对照品进行标化?
► 工作对照品标化分几次标定?几人标定?可接受结果?
► 工作对照品是否需要有有效期?
► 什么时候对工作对照品进行标化?
已开启标准物质稳定性研究
由于有的标准物质的价格比黄金还要贵百倍,所以就引发了已开启的标准物质是否可以重复使用的问题,指南建议是不推荐,但是不代表不可以,使用的前提是一定要制定开启后的效期,规定开启次数和贮存条件,并确认可以确保标准物质没有发生改变才可以使用。
那么已开启标准物质稳定性研究应该做哪些工作呢?指南建议要做相应的研究方案,方案内容要包含贮存条件、开启后密封方式、开启次数、稳定性结果记录以及判定程序,起哄有效性的判断方法是与新开启的标准物质进行比对,但以上操作必须经过质量管理部门批准后才可执行。??
► 已开启的标准物质是否可以重复使用?
► 是否需要制定开启后稳定性研究方案?
► 稳定性研究方案包括哪些内容?
► 开启后标准物质有效性判断方法?
► 稳定性研究方案、报告经哪个部门批准后方可执行?
对照品溶液的稳定性研究
标准物质贵是一个特点,但是对照品溶液用量少也是另外一个特点,每次试验也就几十微升,那么剩余的对照品溶液是否可以再次使用呢?指南给出的建议还是不建议使用,但如果进行了相应研究证明有效性没有变化,那么也是可以继续使用。对照品稳定性研究方案至少要包括配制方法、贮存条件、试验点、接受标准,其中有效性判断可以和新配制的对照品溶液进行比对,观察含量和杂质变化,以上操作经质量管理部门批准后才可以执行。
► 对照品溶液是否可以重复使用?
► 对照品溶液稳定性研究方案包括哪些内容?
► 对照品溶液贮存稳定的有效性如何判断?
► 对照品溶液稳定性研究方案、报告经哪个部门批准后方可执行?
滴定液管理
滴定液系指在容量分析中用于滴定被测物质含量的标准溶液。通常有4位有效数字,以mol/L为单位,配制和标定可以参考《中国药典》通则8006,对于滴定液的管理主要包括采购、验收、配制、标定、标识、贮存、使用和效期管理。
► 滴定液管理要求基础要求?
► 滴定液的采购、验收
► 滴定液的配制、标定
► 滴定液的标识
► 滴定液的贮存、使用
► 滴定液使用效期管理
质量控制实验室GMP指南(2023版)1300问概况及分享规划
GMP指南质量控制实验室共包含15个章节,主要内容如下图所示:
本系列分享共计12期,具体分享规划如下:
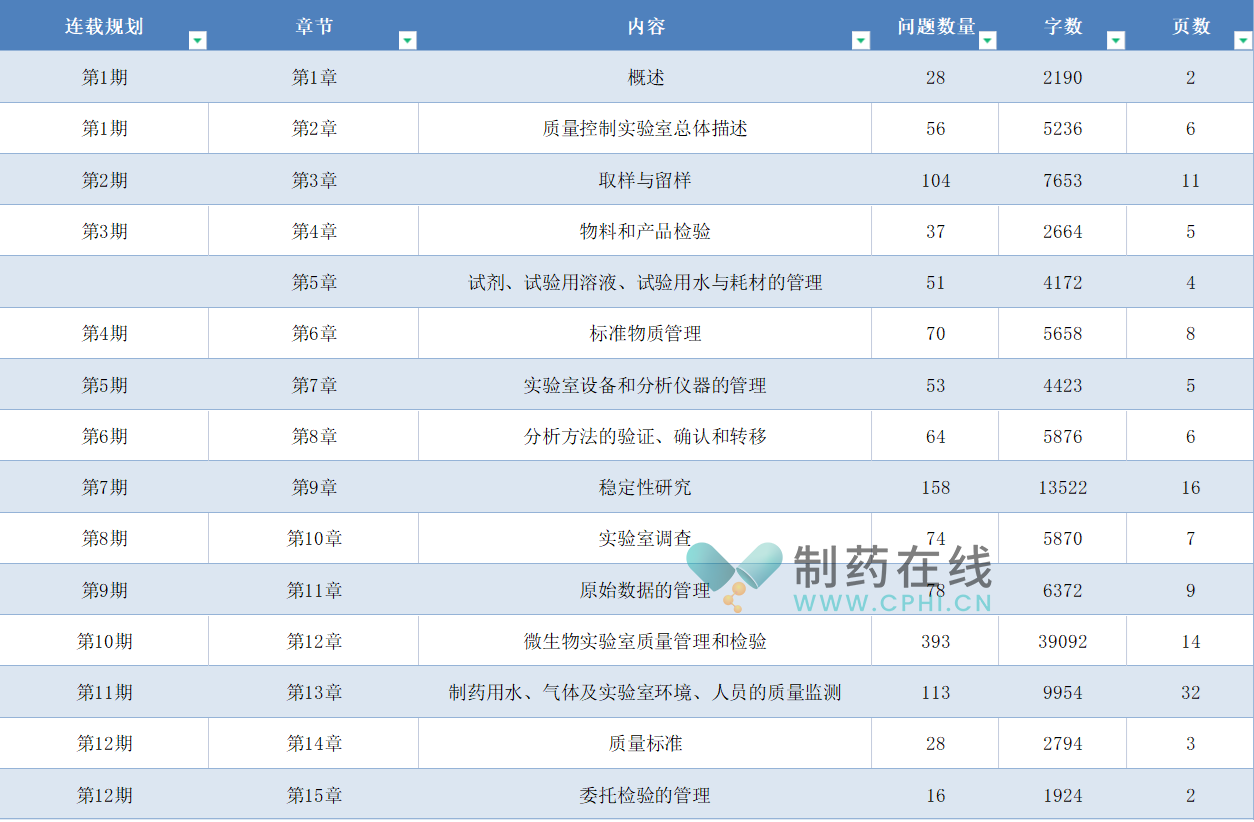
质量控制实验室GMP指南(2023版)1300问电子版将分12期发送
扫描下方二维码进入智药研习社微信社群领取
*已在【1】【2】群的朋友不用重复加群











【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx