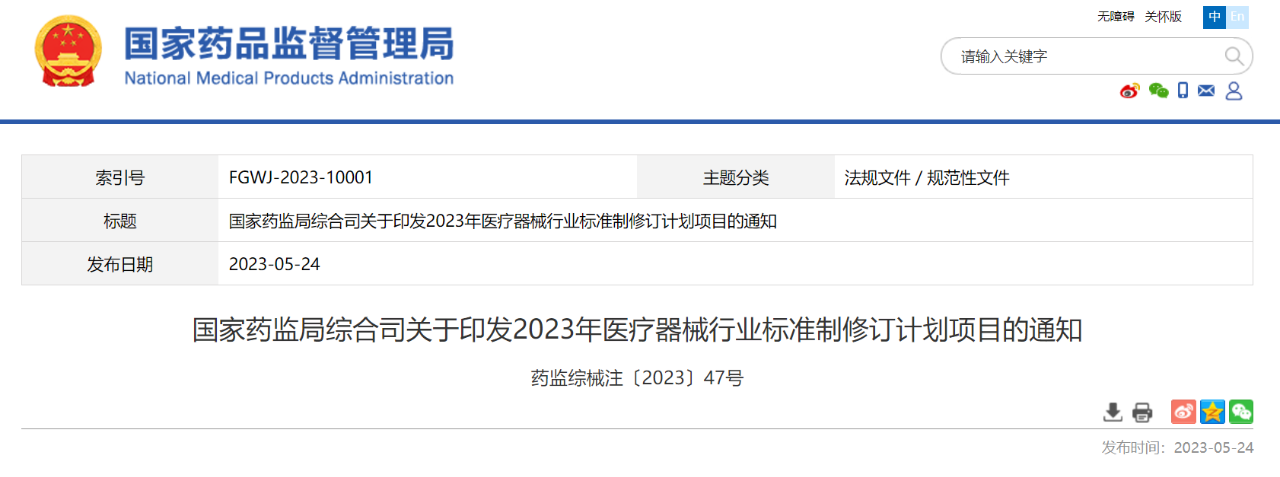
 北京、天津、辽宁、上海、江苏、浙江、山东、湖北、广东省(市)药品监督管理局,中检院(器械标管中心),器审中心,北京大学口腔医学院口腔医疗器械检测中心:为贯彻国务院办公厅《关于全面加强药品监管能力建设的实施意见》,落实《“十四五”国家药品安全及促进高质量发展规划》有关要求,按照国家药监局医疗器械行业标准制修订工作部署,现将2023年医疗器械行业标准制修订计划项目印发给你们,并就有关要求通知如下:一、各相关省(市)药品监督管理局要高度重视,认真组织本行政区域标准承担单位开展标准制修订工作,加强监督管理,确保按要求完成各项工作任务。二、国家药监局器械标管中心要认真组织协调各医疗器械标准化(分)技术委员会、工作组及技术归口单位,严格按照《医疗器械标准制修订工作管理规范》开展标准制修订工作,加强业务管理和检查指导,保证标准质量和水平。三、承担标准制修订任务的医疗器械标准化(分)技术委员会、工作组及技术归口单位要做好标准的组织起草、验证、征求意见和技术审查等工作,要广泛调研、深入研究,确保标准技术内容的科学性、合理性、适用性以及与相关政策要求的符合性。
北京、天津、辽宁、上海、江苏、浙江、山东、湖北、广东省(市)药品监督管理局,中检院(器械标管中心),器审中心,北京大学口腔医学院口腔医疗器械检测中心:为贯彻国务院办公厅《关于全面加强药品监管能力建设的实施意见》,落实《“十四五”国家药品安全及促进高质量发展规划》有关要求,按照国家药监局医疗器械行业标准制修订工作部署,现将2023年医疗器械行业标准制修订计划项目印发给你们,并就有关要求通知如下:一、各相关省(市)药品监督管理局要高度重视,认真组织本行政区域标准承担单位开展标准制修订工作,加强监督管理,确保按要求完成各项工作任务。二、国家药监局器械标管中心要认真组织协调各医疗器械标准化(分)技术委员会、工作组及技术归口单位,严格按照《医疗器械标准制修订工作管理规范》开展标准制修订工作,加强业务管理和检查指导,保证标准质量和水平。三、承担标准制修订任务的医疗器械标准化(分)技术委员会、工作组及技术归口单位要做好标准的组织起草、验证、征求意见和技术审查等工作,要广泛调研、深入研究,确保标准技术内容的科学性、合理性、适用性以及与相关政策要求的符合性。02
03
国家药监局药审中心网站发布关于公开征求《关于无参比制剂品种仿制研究的公告(征求意见稿)》意见的通知
5月24日,国家药监局药审中心网站发布关于公开征求《关于无参比制剂品种仿制研究的公告(征求意见稿)》意见的通知。全文如下。为积极做好无参比制剂品种仿制研究工作,药审中心在前期调研的基础上,起草了《关于无参比制剂品种仿制研究的公告(征求意见稿)》。经请示国家药监局同意,现在中心网站予以公示,以广泛听取各界意见和建议。我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。您的反馈意见请发到以下联系人的邮箱:联系人:王佳、汪小燕邮箱:wangjia@cde.org.cn,wangxiaoyan@cde.org.cn感谢您的参与和大力支持!附件:
1. 《关于无参比制剂品种仿制研究的公告(征求意见稿)》2. 《关于无参比制剂品种仿制研究的公告(征求意见稿)》起草说明
3. 《关于无参比制剂品种仿制研究的公告(征求意见稿)》征求意见反馈表

识别二维码即可查看附件
04
 各有关单位、药品生产企业:为做好自费药品挂网相关工作,根据《关于进一步优化本市药品分类挂网全面议价采购有关事项的通知》(沪药事药品〔2022〕18号)的要求,现就自费药品挂网有关事项通知如下:一、药品信息公布2023年5月24日药品信息将通过“上海市医药采购服务与监管信息系统”(以下简称阳光平台)向医疗机构推送,2023年5月26日生效议价。药品信息公布后,请各药品生产企业核对药品信息,如有疑义及时向市药事所反馈。二、药品议价采购药品挂网采购价由医疗机构与生产企业通过阳光平台议价产生,议价结果双方确认后方可采购。议价结果不得高于同企业同品种五省市最低采购价;无五省市采购价格的,原则上议价结果不得高于同企业同品种十省市最低采购价。三、外省市采购价格更新外省市采购价格如有更新,企业应在新的采购价格执行之日起一个月内,及时在阳光平台内更新采购价格,经市药事所审核通过后生效。特此通知。
各有关单位、药品生产企业:为做好自费药品挂网相关工作,根据《关于进一步优化本市药品分类挂网全面议价采购有关事项的通知》(沪药事药品〔2022〕18号)的要求,现就自费药品挂网有关事项通知如下:一、药品信息公布2023年5月24日药品信息将通过“上海市医药采购服务与监管信息系统”(以下简称阳光平台)向医疗机构推送,2023年5月26日生效议价。药品信息公布后,请各药品生产企业核对药品信息,如有疑义及时向市药事所反馈。二、药品议价采购药品挂网采购价由医疗机构与生产企业通过阳光平台议价产生,议价结果双方确认后方可采购。议价结果不得高于同企业同品种五省市最低采购价;无五省市采购价格的,原则上议价结果不得高于同企业同品种十省市最低采购价。三、外省市采购价格更新外省市采购价格如有更新,企业应在新的采购价格执行之日起一个月内,及时在阳光平台内更新采购价格,经市药事所审核通过后生效。特此通知。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx