研发投入历来是药企保持竞争力的重头戏。随着上半年大型跨国药企的业绩报告披露逐渐接近尾声,我们统计了已披露半年报的 MNC 们的 R&D 投入情况:
2021 年上半年跨国药企研发费用情况(单位:亿$)
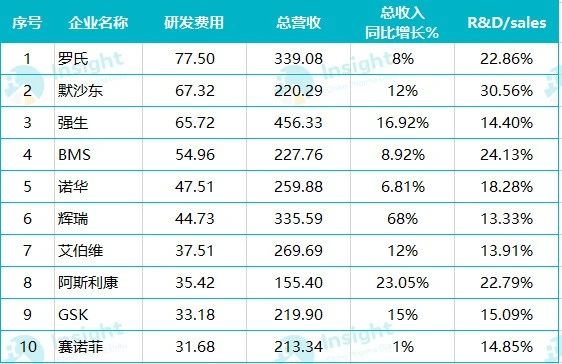
资料来源:各公司公告 Insight 整理
注:目前诺和诺德、再生元、拜耳尚未披露
从上表可以看出,今年上半年以上 10 大药企研发费用合计投入 496 亿美元左右,研发费用占总营收均值达到 18%。其中,默沙东、罗氏、BMS 和阿斯利康这 4 家的研发营收占比均超过了 20%,以默沙东为最高,达到了 30%,其次是 BMS 占 24%,罗氏和阿斯利康占 22% 左右。而从营收来看,相较于往年,强生、罗氏居于一、二位依然强势,而辉瑞则以新冠 mRNA 疫苗的收入带动营收暴涨 68%,居于第三位。
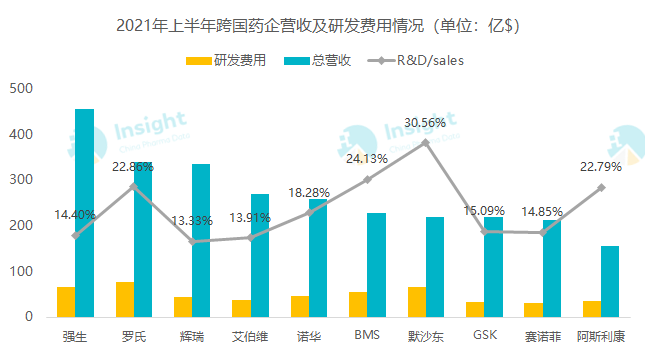
数据来源:各公司中期业绩报告 Insight 整理
下面,我们来看看罗氏、强生、辉瑞和诺华这 4 家公司的研发情况:
罗氏制药
2021 年上半年,罗氏投入研发 77.5 亿美元,占营收 23%。
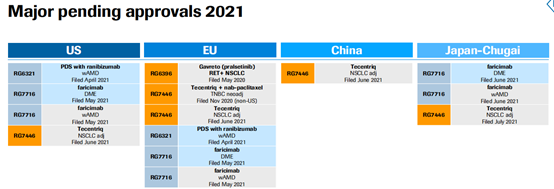
根据罗氏公告,2021Q2 罗氏共 3 项上市申请获批(1NME+2AIs),3 项处于申请阶段(1NME+2AIs),启动 5 项 III 期临床试验(1NME+4AIs),4 项 II 期临床试验 (3NMEs+1AI),2 个新分子进入临床 I 期,进入临床及之后阶段的在研管线数总计达 150 个。
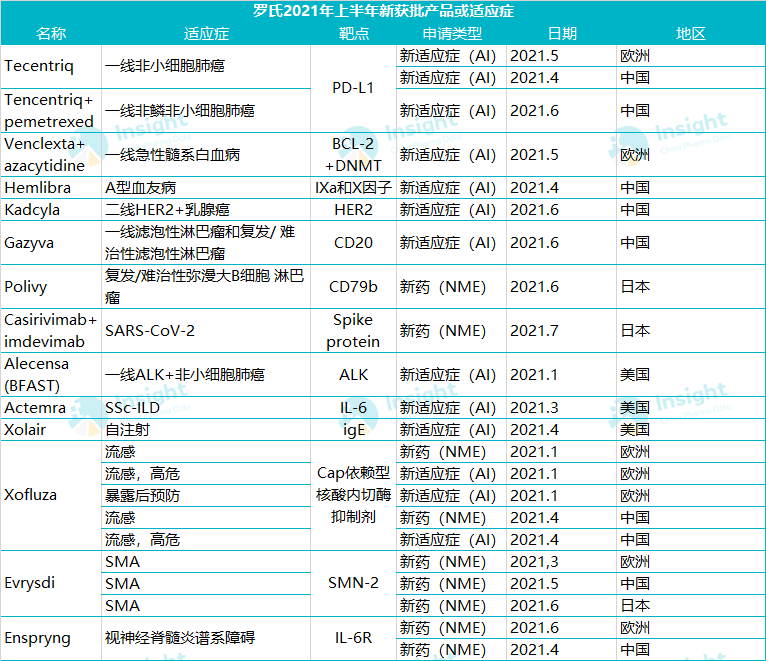
资料来源:罗氏公告 国盛证券 Insight 整理
作为全球药企领头羊,罗氏积极推进新项目至 3 期临床,为公司发展带来源源不断的动力。下半年,罗氏预计还将披露 5 项关键临床数据将在 2021 年下半年释出,包括 CD3/CD20 双抗 mosunetuzumab 用于三线及以后滤泡性淋巴瘤,CD3/CD20 双抗 glofitamab 用于三线及以后弥漫性大 B 细胞淋巴瘤等。同样的,还会有多款新药将获批上市。
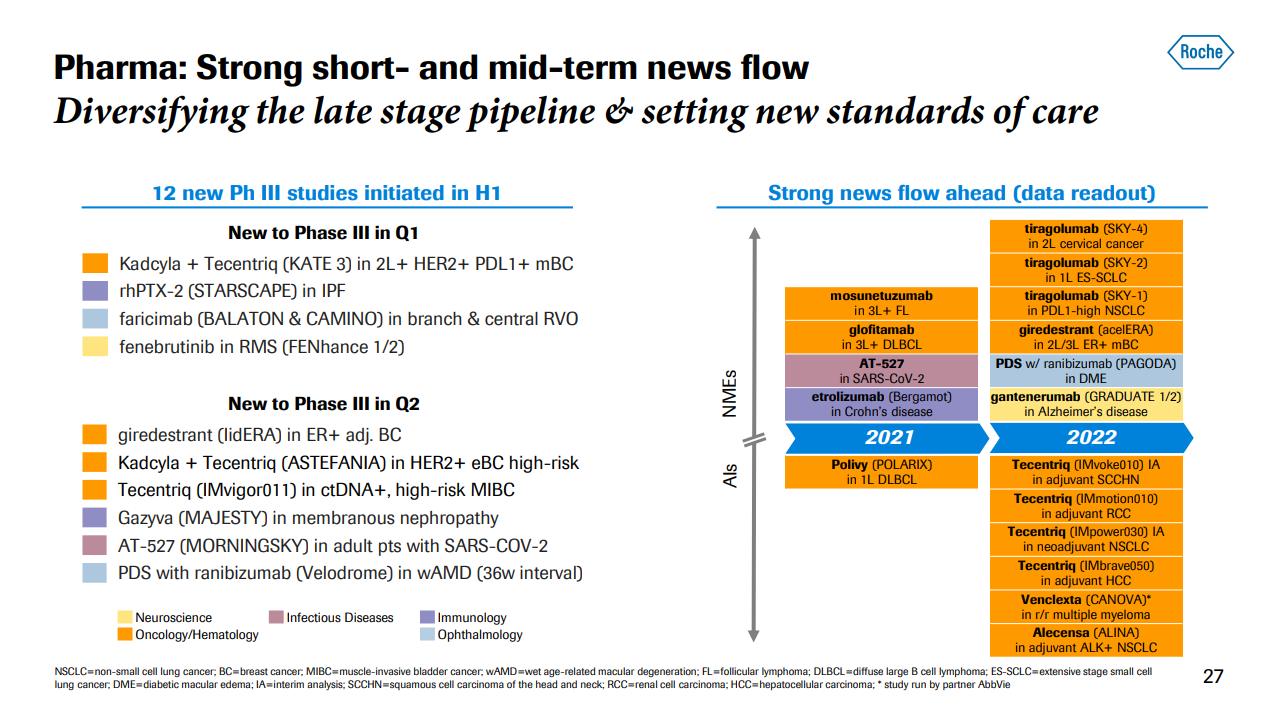
来自:罗氏公告
在今年上半年,罗氏的研发管线中有不少值得关注的新进展。包括 PD-L1 阿替利珠单抗在早期辅助治疗方面的临床突破,以及双抗眼药在 FDA 获得的监管认可:
在 2021 ASCO 大会上,罗氏宣布了 PD-L1 阿替利珠单抗 3 期临床 IMpower010 研究数据。该项试验是首个在早期肺癌辅助免疫治疗中获得阳性结果的 III 期临床研究,在接受完全性切除手术和辅助化疗后的早期 NSCLC 患者中比较 Tencentriq 单抗和最佳支持治疗(BSC)的疗效。中期结果显示,在 PD-L1 TC≥1%II-IIIA 期人群和所有随机分组的 II-IIIA 期人群中,Tencentriq 单抗组的 DFS 明显优于 BSC 组,差异具有统计学意义。
另一款有重要进展的品种为血管生成素-2/血管内皮生长因子-A(Ang-2/VEGF-A)双抗 Faricimab。该药是首个专为眼内设计的双特异性抗体,有望成为成为首款靶向驱动视网膜疾病两个关键通路的新型眼药。2021 年 7 月 29 日,FDA 授予生物制品许可申请(BLA)优先审评资格,用于治疗湿性(新生血管性)年龄相关性黄斑变性(AMD)和糖尿病性黄斑水肿(DME)。
尽管受到生物类似药的持续影响,但罗氏表示,以固定汇率来看 2021 年销售预计将以中位数增长。在评论集团前六个月的业绩时,罗氏首席执行官 Severin Schwan 表示,归功于新药和 COVID-19 测试业务,罗氏在上半年取得了良好的成绩,制药部门在 Q2 也再次开始增长。
强生制药
强生 2021 年上半年研发费用总计 65.72 亿美元,研发费用占营收 17%,其研发管线覆盖肿瘤、免疫、心血管、抗感染、代谢、神经系统等各个领域,处于临床后期阶段产品共 53 项。

资料来源:强生公告
我们重点看看抗肿瘤板块,该领域在 2021 年上半年也迎来了多项积极进展:
Amivantamab(RYBREVANT):首个针对 EGFR 外显子 20 插入突变的 EGFR/c-Met 双抗药物,在今年上半年获 FDA 加速批准上市,用于含铂化疗失败后病情进展的 EGFR ex20ins+ 转移性 NSCLC 成人患者。这是该类突变患者迎来的首款治疗药物,目前该药在中国也已经被授予突破性疗法认定,并启动了 III 期临床。
BCMA CAR-T Ciltacabtagene autoleucel:与南京传奇合作开发,2 季度已经完成了向 FDA 滚动递交生物制剂许可申请(BLA),并向 EMA 提交上市申请,用于复发性和/或难治性多发性骨髓瘤(R/R MM)。BCMA CAR-T 用于 R/R MM 的市场前景值得期待,今年 3 月刚刚获批的 BMS 同类产品 Abecma 刚刚披露首季度销售情况,实现 2400 万美元收入,高于此前其他 CAR-T 产品的首季度销售额。
达雷妥尤单抗(DARZALEX,CD38): DARZALEX SC 在欧洲获批,用于治疗新诊断的系统性轻链(AL)淀粉样变性的成年患者,并额外获批用于多发性骨髓瘤二线治疗;DARZALEX FASPRO 联合泊马度胺和地塞米松用于多发性骨髓瘤(MM);
伊布替尼(IMBRUVICA, BTKi):2021 EHA 上,强生公布了 Ph3 GLOW 研究的数据。GLOW 研究是第一个探索固定疗程伊布替尼联合维奈克拉一线治疗 CLL/小淋巴细胞淋巴瘤(SLL)的随机对照临床研究。结果显示,与 chlorambucil + obinutuzumab (Clb+O) 对比,口服 Imbruvica + Venclexta 显示更优越的无进展生存期(PFS)。此外,Imbruvica + Venclexta 可延长缓解持续时间,并显著改善患者群体的缓解深度;
阿帕他胺(ERLEADA,ARi):2021 ASCO 上,强生公布了 Ph3 TITAN 研究的数据,Erleada 加雄激素剥夺疗法(ADT)治疗转移性去势敏感性前列腺癌(mCSPC)患者的总体生存率得到显著提高,在 44 个月后仍具统计学上显著的 OS 获益,与单独的 ADT 相比,死亡风险降低 35%。
诺华制药
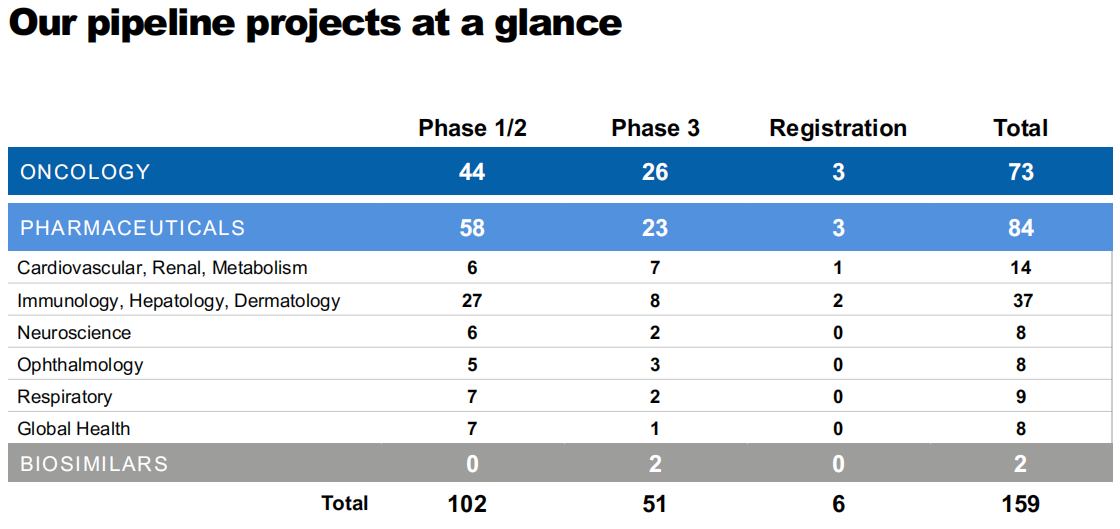
诺华 2021 上半年研发费用总计 47.51 亿美元,研发费用占营收为 18%。目前研发管线数近 160 项,覆盖肿瘤、免疫和肝病及皮肤、心血管及代谢、神经系统、呼吸系统、眼科等疾病领域。
资料来源:诺华公告
同样看看诺华在 2021 上半年的肿瘤药领域进展:
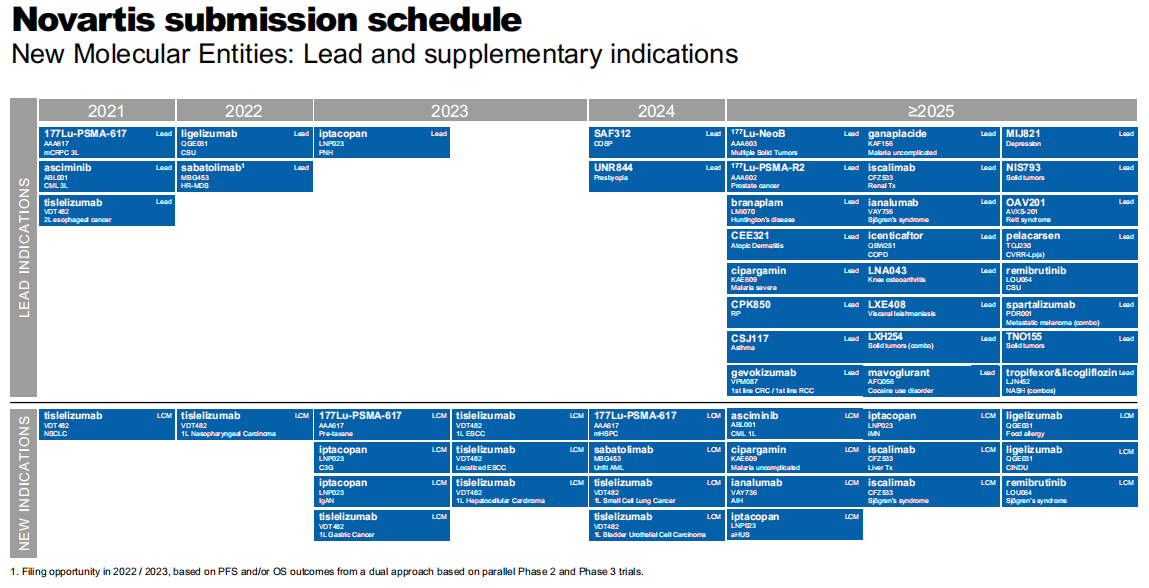
Asciminib(ABL001, Bcr-Abl):向 FDA 提交上市申请,用于(1)用于治疗先前已接受过至少 2 种酪氨酸激酶抑制剂(TKI)治疗、费城染色体阳性慢性髓性白血病慢性期(Ph+CML-CP)成人患者;(2)用于治疗携带 T315I 突变的 Ph+CML-CP 成人患者。
Kymriah (CAR-T CD19):Ph2 ELARA 研究中,对复发或难治性 (r/r) 滤泡性淋巴瘤患者的初步分析显示,一次性 Kymriah 输注的完全缓解率为 66%,总缓解率为 86%。在 ELARA 试验中无 3/4 级细胞因子释放综合征产生。该结果发表于 2021ASCO。
卡马替尼 (Tabrecta,MET):针对携带 MET 外显子 14 跳跃(MET ex14 skipping)突变的转移性 NSCLC 成人患者,一线治疗(初治)患者中位总生存期 (OS) 为 20.8 个月,先前接受过治疗(经治)患者中位总生存期 (OS) 为 13.6 个月。对其他患者进行扩展队列分析,一线患者总缓解率 (ORR) 为 65.6%,二线患者为 51.6%。
替雷利珠单抗 (PD-1):Ph3 RATIONALE 302 试验表明,tislelizumab 与化疗相比,使既往接受过全身疗法的晚期或转移性食管鳞癌死亡风险降低了 30%,中位总生存期延长了 2.3 个月。在 PD-L1 阳性患者中,tislelizumab 使中位 OS 延长 3.5 个月,死亡风险降低了 46%。Ph2 RATIONALE 209 研究显示,tislelizumab 在既往治疗、局部晚期、不可切除或转移性微卫星不稳定性高 (MSI-H) 和错配修复缺陷 (dMMR) 癌症患者中,具有持久的抗肿瘤活性。
瑞波西利 (Kisqali,CDK4/6):Ph3 MONALEESA-3 研究显示,中位总生存期 (OS) 为 53.7 个月,Kisqali 延长了绝经后 HR+/HER2-转移性乳腺癌 (MBC) 患者寿命,结果发表于 2021ASCO 大会。MONALEESA-7 亦显示绝经前妇女 OS 获益。
Lutathera (GEP-NET):Ph3 NETTER-1 研究最终分析显示,与对照组 [36.3 个月 (95%CI: 25.9-51.7)] 相比,Lutathera 组中位总生存期 (OS) 延长了 11.7 个月 [48.0 个 月 (95%CI: 37.4-55.2)]。最终的 OS 分析尚无统计学意义,Lutathera 组的 OS 风险 比 (HR): 0.84, 95% CI: (0.60, 1.17) (p=0.30,双侧) 更为有利。
Sabatolimab(MBG453,TIM-3):获 FDA 快速通道 (FTD) 认定,与低甲基化药物联用治疗 IPSS-R 高风险或极高风险的骨髓增生异常综合征 (MDS) 成人患者,在 AML 和 MDS 获得持续应答,MDS 患者中总缓解率为 58%。数据发表于 2021 EHA 年会。
资料来源:诺华公告
辉瑞制药
辉瑞 2021 年上半年总营收 336 亿美元,同比增长 68%,主要由新冠疫苗 BNT162b2 的强力推动。BNT162b2 疫苗上半年总营收 113 亿美元。
上半年研发投入 44.7 亿美元,2021Q2 研发费用 24.59 亿美元(+17%),多个治疗领域研发投入增加,BNT162b2 的开发和治疗 COVID-19 的疗法相关研发投入明显。
新冠疫苗研发进展
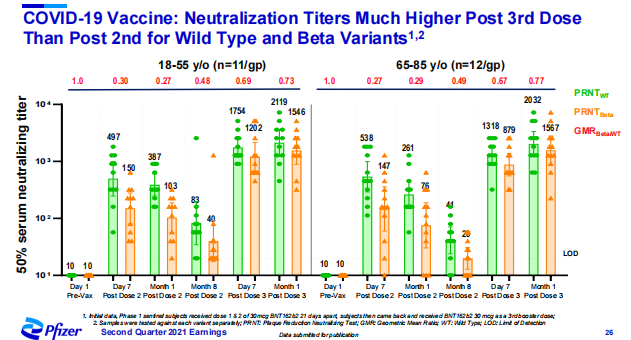
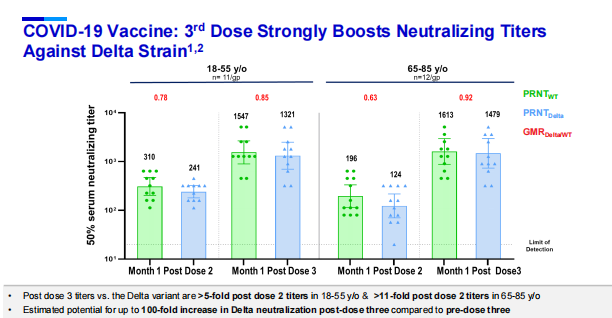
2021 年 7 月 30 日,辉瑞公布了 BNT162b2 疫苗在 3 期临床试验中的 6 个月安全性和效力数据。数据显示,在接种第二剂疫苗后 6 个月里,BNT162b2 预防出现症状的 COVID-19 的整体效力为 91%。
资料来源:辉瑞公告
疫苗的防护效力随着时间的推移有一定程度的下降,在接种两剂疫苗之后,防护效力的峰值为 96.2%(接种后 7 天~2 个月);接种后 2~4 个月疫苗效力为 90.1%;接种后 4~6 个月疫苗效力为 83.7%。
资料来源:辉瑞公告
在预防严重 COVID-19 方面,6 个月后总计发现 31 名患者,其中 30 名出现在安慰剂组,1 名出现在疫苗组,计算出的保护效力为 96.7%。
辉瑞预计最早于今年 8 月递交关于追加第三剂疫苗接种的紧急使用授权(EUA)申请。
COVID-19 口服蛋白酶抑制剂(PF-07321332)
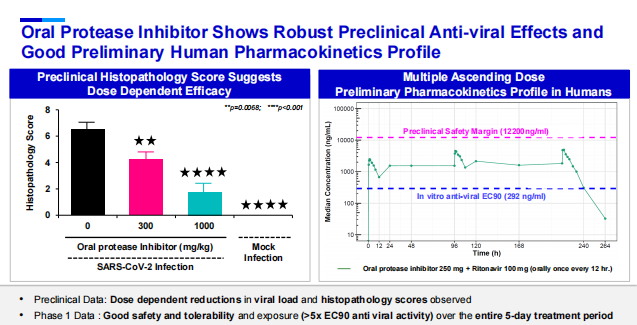
PF-07321332 对 SARS-CoV-2 和其他冠状病毒表现出有效的、选择性的体外抗病毒活性。此外,它还在体外人类细胞和感染 SARS-CoV-2 的动物中显示出强大的临床前抗病毒作用。在健康志愿者的 1 期药代动力学研究中,PF-07321332 显示出超过 10 天的高药物暴露,超过预测的抑制 SARS-CoV-2 病毒复制的暴露水平五倍以上。
资料来源:辉瑞公告
基于这些数据,辉瑞于 2021 年 7 月启动了一项针对 COVID-19 患者的 2/3 期试验。该试验的数据预计将于 2021 年第四季度发布。
第一代 4 价 mRNA 流感疫苗(辉瑞与 BioNTech 公司合作开发)
辉瑞与 BioNTech 公司合作开发第一代 4 价 mRNA 流感疫苗,在动物实验中激发的抗流感病毒抗体水平与已有的包含佐剂的三价蛋白亚基疫苗相当或更高。
新冠疫苗的开发过程加速验证了 mRNA 疫苗开发的所有流程,有望大幅度加快 mRNA 流感疫苗的开发,辉瑞预计 mRNA 流感疫苗的首个人体试验将在第三季度展开。
作者:清漪
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx